- Perry MC, Demeule M, Régina A, Moumdjian R, Béliveau R (2010) Curcumin inhibits tumor growth and angiogenesis in glioblastoma xenografts. Mol. Nutr. Food Res. 2010; 53, 1-10
- Ché C, Yang G, Thiot C, Lacoste MC, Currie JC, Demeule M, Régina A, Béliveau R, Castaigne JP (2010) New Angiopep-Modified Doxorubicin (ANG1007) and Etoposide (ANG1009) Chemotherapeutics With Increased Brain Penetration. J. Med. Chem. 2010; 53(7):2814-2824
- Annabi B, Doumit J, Plouffe K, Laflamme C, Lord-Dufour S & Béliveau R (2010) Members of the low density lipoprotein receptor-related-proteins provide a differential molecular signature between parental and CD133(+) DAOY medulloblastoma cells Molecular Carcinogenesis 2010:49(7) 710-717
- Nyalendo C, Sartelet H, Gingras D, Béliveau R (2010) Inhibition of membrane-type 1 matrix metalloproteinase tyrosine phosphorylation blocks tumor progression in mice.Anticancer Research 2010; 30:1887-1896
- Lamy S, Lachambre M-P, Lord-Dufour S, Béliveau R (2010) Propranolol suppresses angiogenesis in vitro: inhibition of proliferation, migration, and differentiation of endothelial cells. Vascular Pharmacology 53(2010) 200-208
- Annabi B, Vaillancourt-Jean E, Weil AG & Béliveau R (2010) Pharmacological targeting of b-adrenergic receptor functions abrogates carcinogen-mediated MMP-9 secretion through NF-kB signalling in medulloblastoma cells OncoTargets and Therapy 3:219-226
Vídeo Explicando Lair Ribeiro VERSUS Medicina Convencional
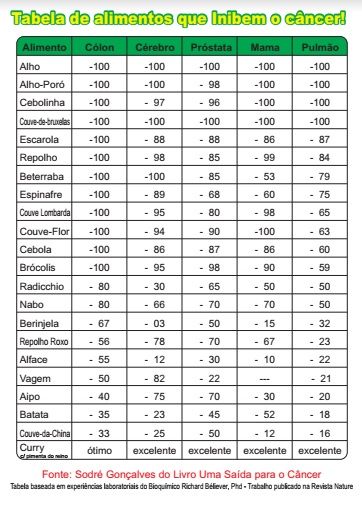
A Tabela acima é um resumo de 400 páginas do livro de Belivéau que foi baseado nas suas centenas de pubicações na NATURE e demais jornais científicos.
O Dr Béliveau publicou soluções naturais para câncer e tem sido um ícone na divulgação de uma ciência que estará na lata do lixo devido não haver intere$$e ou vislumbre de retorno para investimento de se produzir soluções cientificas naturais , por parte de quem tem dinheiro para bancar a cara pesquisa clinica ( que gira em torno de 1 bilhão de dolares).
Precisamos promover a mudança de leis e do sistema de convalidação de fitoterápicos dos testes clínicos e PRESSIONARMOS órgãos reguladores como a ANVISA que hoje trabalha nitidamente para a industria farmacêutica, para aprovar remédios naturais como remédios e não apenas como suplementos e outros nomes ultrajantes .
melão de são caetano indicado pra pancreas
https://www.secondopinionnewsletter.com/Health-Alert-Archive/View-Archive/2172/Simple-plant-kills-up-to-98-of-cancer-cells--and-stops-diabetes.htm
raiz de dente de leão
http://www.uwindsor.ca/dailynews/2015-02-18/human-clinical-trials-cancer-killing-dandelion-extract
Publications 2010 (faltam 7 anos de atualização)
Publicações sobre influência da mente no câncer https://faculty.mdanderson.org/profiles/lorenzo_cohen.html
RESPOSTA AO DRAUZIO VARELLA
https://www.youtube.com/watch?v=nvFh599nOrE&feature=share
REFERÊNCIAS E NOTAS
“Se aprovássemos automaticamente as drogas porque foram registradas nos Estados Unidos, teríamos uma enxurrada de produtos americanos eliquidaríamos a indústria nacional.”
FONTE:
http://epoca.globo.com/
FASE PRE-CLINICA custa 100 a 200 mil (in vitro e em animais)
FASE CLINICA pode chegar a bilhões em gastos (testes humanos) só pra dar entrada na paPelada se gasta em torno de milhões
QUIMIOTERAPIA INVASIVAS 98% INEFICIENTE E ASSASSINA
https://
RESULTADOS:
A contribuição global da quimioterapia citotóxica curativa e adjuvante para a sobrevivência a 5 anos em adultos foi estimada em 2,3% na Austrália e em 2,1% nos EUA.
http://www.icnr.com/
http://
http://doutissima.com.br/
TRATAMENTOS NÃO INVASIVOS PARA O CANCER
http://
http://
http://
RESOLUÇÃO CFM Nº 1.938/2010 http://
FOSFOETANOLAMINA
http://www.nature.com/cdd/
http://
http://
http://www.google.com/
http://www.amazon.com/
http://
"Evidenciamos que numa amostra de 110 faculdades de medicina,70% delas não apresentam a disciplina de oncologia na grade curricular. Nas 33 faculdades de medicina que possuem a disciplina,7 delas possuem-na apenas como optativa.http://www.sboc.org.br/
http://
REFERENCIAS A LAIR RIBEIRO
Para quem ler alguem falando mal do Lair , posto aqui referencias cientificas que o referenciam
72 artigos dele como autor e co-autor , fora livros e um monte de estudos
https://
Sobre controversia entre colesterol
http://bmjopen.bmj.com/
Sobre a controversia ligada a LEITE E CALCIO , alguns estudos :
Demasiada láctea, os carboidratos podem prejudicar o esperma dos homens
Cobertura no US News & World Report, 26 de outubro de 2012, com o Jorge Chavarro da HSPH
https://
O consumo freqüente de lácteos com baixo teor de gordura pode aumentar o risco de doença de Parkinson
O consumo de três ou mais porções de lácteos com baixo teor de gordura a cada dia foi associado a um risco maior de ser diagnosticado com doença de Parkinson (PD) em um grande estudo de homens e mulheres dos EUA, de acordo com um novo artigo da Harvard TH Chan School
https://
fraturas em adolescentes e adultos e consumo de leite
http://jamanetwork.com/
O consumo freqüente de lácteos com baixo teor de gordura pode aumentar o risco de doença de Parkinson
O consumo de três ou mais porções de lácteos com baixo teor de gordura a cada dia foi associado a um risco maior de ser diagnosticado com doença de Parkinson (PD) em um grande estudo de homens e mulheres dos EUA, de acordo com um novo artigo da Harvard TH Chan School
https://
O alto consumo de leite pode diminuir o tempo de vida através do aumento do estresse oxidativo.
https://academic.oup.com/
Fonte: Sodré Neto
LAIR RIBEIRO PARA DIRETOR DA ANVISA
https://www.facebook.com/
Referências em fitoterapias do cancer
Publications 2010
- Perry MC, Demeule M, Régina A, Moumdjian R, Béliveau R (2010) Curcumin inhibits tumor growth and angiogenesis in glioblastoma xenografts. Mol. Nutr. Food Res. 2010; 53, 1-10
- Ché C, Yang G, Thiot C, Lacoste MC, Currie JC, Demeule M, Régina A, Béliveau R, Castaigne JP (2010) New Angiopep-Modified Doxorubicin (ANG1007) and Etoposide (ANG1009) Chemotherapeutics With Increased Brain Penetration. J. Med. Chem. 2010; 53(7):2814-2824
- Annabi B, Doumit J, Plouffe K, Laflamme C, Lord-Dufour S & Béliveau R (2010) Members of the low density lipoprotein receptor-related-proteins provide a differential molecular signature between parental and CD133(+) DAOY medulloblastoma cells Molecular Carcinogenesis 2010:49(7) 710-717
- Nyalendo C, Sartelet H, Gingras D, Béliveau R (2010) Inhibition of membrane-type 1 matrix metalloproteinase tyrosine phosphorylation blocks tumor progression in mice. Anticancer Research 2010; 30:1887-1896
- Lamy S, Lachambre M-P, Lord-Dufour S, Béliveau R (2010) Propranolol suppresses angiogenesis in vitro: inhibition of proliferation, migration, and differentiation of endothelial cells. Vascular Pharmacology 53(2010) 200-208
- Annabi B, Vaillancourt-Jean E, Weil AG & Béliveau R (2010) Pharmacological targeting of b-adrenergic receptor functions abrogates carcinogen-mediated MMP-9 secretion through NF-kB signalling in medulloblastoma cells OncoTargets and Therapy 3:219-226
Publications 2009
- Annabi B, Lachambre MP, Plouffe K, Sartelet H & Béliveau R (2009) Modulation of invasive properties of CD133(+) glioblastoma stem cells : A role for MT1-MMP in bioactive lysophospholipid signaling Molecular Carcinogenesis 48(10):910-919
- Annabi B, Laflamme C, Sina A, Lachambre MP, Béliveau R (2009) A MT1-MMP/NF-kB signaling axis as a checkpoint controller of COX-2 expression in CD133(+) U87 glioblastoma cells. Journal of Neuroinflammation 6(1):8
- Labbé D, Provençal M, Lamy S, Boivin D, Gingras D and Béliveau R (2009) The Flavonols Quercetin, Kaempferol, and Myricetin Inhibit Hepatocyte Growth Factor-Induced Medulloblastoma Cell Migration J. Nutr. 2009;139 646-652
- Provençal M, Labbé D, Veitch R, Boivin D, Rivard G-E, Sartelet H, Robitaille Y, Gingras D and Béliveau R (2009) c-Met activation in medulloblastoma induces tissue factor expression and activity: effects on cell migration. Carcinogenesis 2009 30: 1089-1096
- Gingras D, Béliveau R (2009) Emerging concepts in the regulation of membrane type-1 matrix metalloproteinase activity. Biochim. Biophys. Acta Mol. Cell Res. (in press)
- Annabi B, Lachambre MP, Plouffe K, Moumdjian R & Béliveau R (2009) Propranolol adrenergic blockade inhibits human brain endothelial cells tubulogenesis and matrix metalloproteinase-9 secretion Pharmacological Research 60(5):438-445
- Bertrand Y, Currie JC, Demeule M, Régina A, Ché C, Abulrob A, Fatehi D, Sartelet H, Gabathuler R, Castaigne JP, Stanimirovic D, Béliveau R (2009) Transport characteristics of a novel peptide platform for CNS therapeutics. J Cell Mol Med. 2009 Oct 10 (in press).
- Provençal M, Labbé D, Veitch R, Boivin D, Rivard GE, Gingras D, Béliveau R (2009) Tissue factor mediates the HGF/MET-induced anti-apoptotic pathway in DAOY medulloblastoma cells. J. Neuro-oncol. (in press)
- Nyalendo C, Sartelet H, Barrette S, Ohta S, Gingras D, Béliveau R (2009) Identification of membrane-type 1 matrix metalloproteinase tyrosine phosphorylation in association with neuroblastoma progression. BMC Cancer 9, 422
- Dagenais C, Avdeef A, Tsinman O, Dudley A, Béliveau R (2009) P-glycoprotein deficient mouse in situ blood-brain barrier permeability and its prediction using an in combo PAMPA model. Eur J Pharm Sci. 2009:38(2):121-137
- Boivin D, Labbé D, Fontaine N, Lamy S, Beaulieu E, Gingras D, Béliveau R (2009) The stem cell marker CD133 (prominin-1) is phosphorylated on cytoplasmic tyrosine-828 and tyrosine-852 by Src and Fyn tyrosine kinases. Biochemistry. 2009:48(18)3998-4007
Publications 2008
- Provençal M, Michaud M, Beaulieu É, Ratel D, Rivard GE, Gingras D, and Béliveau R (2008) Tissue factor pathway inhibitor interferes with endothelial cell migration by inhibition of both the Erk pathway and proteins involved in focal adhesions. Thromb. Haemost. 99: 576-585
- Demeule M, Régina A, Ché C, Poirier J, Nguyen T, Gabathuler R, Castaigne J-P, Béliveau R (2008) Identification and design of peptides as a new drug delivery system for the brain. The Journal of Pharmacology and Experimental Therapeutics. 324(3) 1064-1072.
- Annabi B, Rojas-Sutterlin S, Laflamme C, Lachambre MP, Rolland Y, Sartelet H & Béliveau R (2008) Tumor Environment Dictates Medulloblastoma Cancer Stem Cell Expression and Invasive Phenotype. Molecular Cancer Research 6: p. 907-916
- Lamy S, Beaulieu E, Labbé D, Bédard V, Moghrabi A, Barrette S, Gingras D, Béliveau R (2008) Delphinidin, a dietary anthocyanidin, inhibits platelet derived growth fator ligand/receptor (PDGF/PDGFR) signaling. Carcinogenesis. 29(5) 1033-1041
- Barakat S, Turcotte S, Demeule M, Lachambre MP, Régina A, Baggetto LG, Béliveau R (2008) Regulation of Brain Endothelial Cells Migration and Angiogenesis by P-glycoprotein/Caveolin-1 Interaction. Biochemical Biophysical Research Communications. 372(3) 440-446
- Régina A, Demeule M, Ché C, Lavallée I, Poirier J, Gabathuler R, Béliveau R, Castaigne JP (2008) Antitumor activity of ANG1005, a conjugate between paclitaxel and the new brain delivery vector Angiopep-2. British Journal of Pharmacology. 155(2) 185-197
- Demeule M, Currie JC, Bertrand Y, Ché C, Nguyen T, Régina A, Gabathuler R, Castaigne JP, Béliveau R (2008) Involvement of the low-density lipoprotein receptor related protein in the transcytosis of the brain delivery vector Angiopep-2. Journal of Neurochemistry. 106(4) 1534-1544
- Nyalendo C, Beaulieu É, Sartelet H, Michaud M, Fontaine N, Gingras D, and Béliveau R (2008) Impaired tyrosine phosphorylation of membrane type-1 matrix metalloproteinase reduces tumor cell proliferation in three-dimensional matrices and abrogates tumor growth in mice. Carcinogenesis. 29(8) 1655-1664
- Boivin D, Lamy S, Lord-Dufour S, Jackson J, Beaulieu E, Côté M, Moghrabi A, Barrette S, Gingras D, Béliveau R (2008) Antiproliferative and antioxidant activities of common vegetables: A comparative study. Food Chemistry. 112(2009) 374-380
- Lamy S, Bédard V, Sartelet H, Barthomeuf C, Gingras D, Béliveau R (2008) The dietary flavones apigenin and luteolin impair smooth muscle cell migration and VEGF expression through inhibition of PDGFR-? phosphorylation. Cancer Prev. Res. 2008;1(6) November 2008
- Rolland Y, Demeule M, Fenart L, Béliveau R (2008) Inhibition of melanoma brain metastasis by targeting melanotransferrin at the cell surface. Pigment Cell Melanoma Res. 22: 86-98
Publications 2007
- Boivin D, Blanchette M, Barrette S, Moghrabi A and Béliveau R (2007) Inhibition of cancer cell proliferation and suppression of TNF-induced activation of NFkB by edible berry juice. Anticancer Research 27(2):937-948.
- Langlois S, Nyalendo C, Di Tomasso G, Labrecque L, Roghi C, Murphy G, Gingras D and Béliveau R (2007) Membrane-type 1 Matrix Metalloproteinase Stimulates Cell Migration through Epidermal Growth Factor Receptor Transactivation. Mol. Cancer Res. 2007; 5(6):569-583.
- Nyalendo C, Michaud M, Beaulieu E, Roghi C, Murphy G, Gingras D and Béliveau R(2007) Src-dependent phosphorylation of membrane-type 1 matrix metalloproteinase on cytoplasmic tyrosine 573 : Role in endothelial and tumor cell migration. J. Biol. Chem.282(21) : 15690-15699.
- Ratel D, Mihoubi S, Beaulieu E, Durocher Y, Rivard GE, Gingras D and Béliveau R (2007) VEGF increases the fibrinolytic activity of endothelial cells within fibrin matrices: Involvement of VEGFR-2, tPA and matrix metalloproteinases. Thrombosis Res. (in press).
- Rolland Y, Demeule M, Michaud-Levesque J and Béliveau R (2007) Inhibition of tumor growth by a truncated and soluble form of melanotransferrin. Experimental Cell Research 313 (2007) 2910-2919.
- Bertrand Y, Demeule M, Michaud-Levesque J and Béliveau R (2007) Melanotransferrin induces human melanoma SK-Mel-28 cell invasion in vivo. Biochem Biophys Res Commun 353 (2) 418-423.
- Béliveau R and Gingras D (2007) The role of nutrition in cancer prevention. Canadian Family Physician(in press).
- Michaud-Levesque J, Demeule M and Béliveau R (2007) Plasminogen-dependent internalization of soluble melanotransferrin involves the low-density lipoprotein receptor-related protein and annexin II. Biol. Chem. 388 (7) 747-754.
- Gingras D and Béliveau R (2007). Towards a global assessment of the anticancer properties of fruits and vegetables: The Montreal anticancer nutrinome project. Acta Hort. 744, 157-164.
- Desrosiers RR, Beaulieu E, Buchanan M and Béliveau R (2007) Proteomic analysis of human plasma proteins by two-dimensional gel electrophoresis and by antibody arrays following depletion of high abundance proteins. Cell Biochem. and Biophysics. 2007; 49(3):182-195.
- Annabi B, Rojas-Sutterlin S, Laroche M, Lachambre M-P, Moumdjian R and Béliveau R(2007) The diet-derived sulforaphane inhibits matrix metalloproteinase-9-activated human brain microvascular endothelial cell migration and tubulogenesis. Molecular Nutrition and Food Research (in press)
- Lim S, Grassi J, Akhmedjanova V, Debiton E, Balansard G, Béliveau R and Barthomeuf C (2007) Reversal of P-glycoprotein-mediated drug efflux by eudesmin from Haplophyllum perforatum Kar. et Kir. and cytotoxicity pattern versus diphyllin, epi-podophyllotoxine and etoposide. Planta Medica. 2007; 73: 1563-1567
- Gingras D, Michaud M, Di Tomasso G, Béliveau E, Nyalendo C, and Béliveau R(2007) Sphingosine-1-phosphate induces the interaction of membrane type-1 matrix metalloproteinase with p130Cas in endothelial cells. FEBS Lett. 582 (2008) 399-404
Publications 2006
- McLaughlin N, Annabi B, Bouzeghrane M, Temme A, Bahary JP, Moumdjian R and Béliveau R (2006) The survivin-mediated radioresistant phenotype of glioblastomas is regulated by RhoA and inhibited by the green tea polyphenol (-) epigallocatechin-3-gallate. Brain Research. 1071 (2006) 1-9.
- Lamy S, Blanchette M, Michaud-Levesque J, Lafleur R, Durocher Y, Moghrabi A, Barrette S, Gingras D, Béliveau R (2006) Delphinidin, a dietary anthocyanidin, inhibits vascular endothelial growth factor receptor-2 phosphorylation. Carcinogenesis2006 May;27 (5):989-996.
- Annabi B, Bouzeghrane M, Currie JC, Dulude H, Daigneault L. Garde S, Rabbani SA, Panchal C, Wu JJ and Béliveau R (2006) The inhibition of MMP-9 secretion by anti-metastatic PSP94-derived peptide PCK3145 requires cell surface laminin receptors signalling. Anti-cancer Drugs 17(4): 429-438.
- McLaughlin N, Annabi B, Lachambre MP, Kim HS, Bahary JP, Moumdjian R and Béliveau R (2006) Combined low dose ionizing radiation and green tea-derived epigallocatechin-3-gallate treatment induces human brain endothelial cells death. Journal of Neurooncology 80(2):111-121.
- Rolland Y, Demeule M and Béliveau R (2006) Melanotransferrin stimulates t-PA-dependent activation of plasminogen in endohelial cells leading to cell detachment. Biochim Biophys Acta1763(2006) 393-401.
- Annabi B, Currie JC, Bouzeghrane M, Dulude H, Daigneault L, Garde S, Rabbani SA, Panchal C, Wu JJ & Béliveau R (2006) Contribution of the 37-kDa laminin receptor precursor in the anti-metastatic PSP94-derived peptide PCK3145 cell surface binding. Biochemical and Biophysical Research Communications 346(1):358-66.
- Barthomeuf C, Demeule M, Grassi J, Saidkhodjaev A and Béliveau R (2006) Conferone from Ferula Schtschurowskiana enhances vinblastine cytotoxicity in MDCK-MDR1 cells by competitively inhibiting P-glycoprotein transport. Planta Med. 2006 Jun; 72(7):634-9.
- Lamy S, Lafleur R, Bédard V, Moghrabi A, Barrette S, Gingras D and Béliveau R (2006) Anthocyanidins inhibit migration of glioblastoma cells : structure-activity relationship and involvement of the plasminolytic system. J. Cell. Biochem. 100:100-111 (2007).
- Michaud-Levesque J, Demeule M and Béliveau R (2006) In vivo inhibition of angiogenesis by a soluble form of melanotransferrin. Carcinogenesis. 28(2):280-288 (2007).
- Barakat S, Demeule M, Pilorget A, Régina A, Gingras D, Baggetto LG and Béliveau R (2006) Modulation of P-glycoprotein function by Caveolin-1 Phosphorylation. Journal of Neurochemistry. 101(1):1-8 (2007).
- Bertrand Y, Demeule M, Rivard GE and Béliveau R (2006) Stimulation of tPA-dependent provisional extracellular fibrin matrix degradation by melanotransferrin. Biochim Biophys Acta1763(2006):1024-1030.
- Béliveau R, Gingras D (2006) Can foods combat cancer ? Arresting malignancies with diet. Oncology Exchange 5(3):31-34 Jul 2006.
- McLaughlin N, Annabi B, Kim HS, Bahary JP, Moumdjian R & Béliveau R (2006) The response to brain tumor-derived growth factors is altered in radioresistant human brain endothelial cells. Cancer Biology & Therapy 5(11):1539-1545.
- Annabi B, Currie JC, Moghrabi A and Béliveau R (2007) Inhibition of HuR and MMP-9 expression in macrophage-differentiated HL-60 myeloid leukemia cells by green tea polyphenol EGCg Leukemia Research 31(9):1285-1292.
- Pilorget A, Demeule M, Barakat S, Marvaldi J, Luis J and Béliveau R (2006) Modulation of P-glycoprotein function by sphingosine kinase-1 in brain endothelial cells. Journal of Neurochemistry (2007) 100, 1203-1210.
- Pilorget A, Conesa M, Sarray S, Michaud-Levesque J, Daoud S, Kim KS, Demeule M, Marvaldi J, El Ayeb M, Marrakchi N, Béliveau R and Luis J (2006) Lebectin, a Macrovipera lebetina venom-derived C-type lectin, inhibits both in vitro and in vivo angiogenesis. Journal of Cellular Physiology 211:207-315, 2007.
Publications 2005
- Desrosiers RR, Cusson MH, Turcotte S and Béliveau R (2005) The farnesyltransferase inhibitor SCH-66336 down-regulates secretion of matrix proteinases and inhibits carcinoma cell migration. Int. J Cancer 114:702-712.
- Labrecque L, Nyalendo C, Langlois S, Durocher Y, Roghi C, Murphy G, Gingras D, Béliveau R (2004) Src-mediated tyrosine phosphorylation of caveolin-1 induces its association with membrane-type-1 matrix metalloproteinase. J Biol Chem 279:52132-52140.
- Demeule M, Annabi B, Michaud-Lévesque J, Lamy S and Béliveau R (2005) Dietary prevention of cancer: Anticancer and Antiangiogenic Properties of Green Tea Polyphenols. Medicinal Chemistry Reviews2:49-58.
- Michaud-Lévesque J, Rolland Y, Demeule M, Bertrand Y and Béliveau R (2005) Inhibition of endothelial cells migration and tubulogenesis by exogenous human recombinant soluble melanotransferrin: involvement of the uPAR/LRP plasminolytic system. Bioch. Biophys. Acta. 1743 (243-253).
- Ratel D, Glazier G, Provençal M, Boivin D, Beaulieu E, Gingras D, and Béliveau R (2005) Direct-acting fibrinolytic enzymes in shark cartilage extract: Potential therapeutic role in vascular disorders. Thrombosis Res. 115:143-152.
- Labrecque L, Lamy S, Chapus A, Mihoubi S, Durocher Y, Cass B, Bojanowski MW, Gingras D and Béliveau R (2005) Combined inhibition of PDGF end VEGF receptors by ellagic acid, a dietary-derived phenolic compound. Carcinogenesis 26:821-826.
- Barthomeuf C, Grassi J, Demeule M, Fournier C, Boivin D and Béliveau R (2005) Inhibition of P-glycoprotein transport function and reversion of MDR1 multidrug resistance by cnidiadin. Cancer Chemotherapy and Pharmacology. 56:173-181.
- Langlois S, Di Tomasso G, Boivin D, Roghi C, Murphy G, Gingras D and Béliveau R (2005) Membrane type 1-matrix metalloproteinase induces endothelial cell morphogenic differentiation by a caspase-dependent mechanism. Exp. Cell Res. 307:452-464.
- Annabi B, Bouzeghrane M, Moumdjian R, Moghrabi A and Béliveau R (2005) Probing the infiltrating character of brain tumors : Inhibition of RhoA/ROK-mediated CD44 cell surface shedding from glioma cells by the green tea catechin EGCg. Journal of Neurochemistry 94:906-916.
- Pilorget A, Annabi B, Bouzeghrane M, Marvaldi J, Luis J and Béliveau R (2005) Inhibition of angiogenic properties of brain endothelial cells by platelet-derived sphingosine-1-phosphate. Journal of Cerebral Blodd Flow & Metabolism 25:1171-1182.
- Caron A, Desrosiers RR, Langlois S and Béliveau R (2005) Ischemia-reperfusion injury stimulates gelatinase expression and activity in kidney glomeruli. Can. J. Physiol. Pharmacol. 83:287-300.
- Perri SR, Nalbantoglu J, Annabi B, Koty Z, Lejeune L, François M, Di Falco MR, Béliveau R and Galipeau J (2005) Plasminogen Kringle 5-engineered glioma cells block migration of tumor-associated macrophages and suppress tumor vasulatization and progression. Cancer Research. 65:8359-8365.
- Annabi B., Bouzeghrane M., Currie JC., Hawkins R., Dulude H., Daigneault L., Ruiz M.,Wisniewski J., Garde S., Rabbani SA., Panchal C., Wu JJ. & Béliveau R (2005) A PSP-derived synthetic peptide PCK3145 inhibits MMP-9 secretion and triggers CD44 cell surface shedding : Implications in tumor metastasis. Clinical & Experimental Metastasis 22:429-439.
- Barthomeuf C, Lamy S, Blanchette M, Boivin D, Gingras D and Béliveau R (2005) Inhibition of sphingosine-1-phosphate- and vascular endothelial growth factor-induced endothelial cell chemotaxis by red grape skin polyphenols correlates with a down-regulation of PAF synthesis. Free Rad. Biol. Med. 40 (2006) 581-590.
- Caron A, Desrosiers RR and Béliveau R (2005) Ischemia injury alters endothelial properties of kidney cortex: Stimulation of MMP-9. Exp. Cell Res. 310:105-116.
- El Hader C, Tremblay S, Solban N, Gingras D, Béliveau R, Orlov S N, Hamet P and Tremblay J (2005) HcaRG increases renal cell migration by an internal TGF-a autocrine loop mechanism. Am J Physiol 289:F1273-80.
Publications 2004
- Régina A, Jodoin J, Khoueir P, Rolland Y, Berthelet F, Moumdjian R, Fenart L, Cecchelli R, Demeule M and Béliveau R (2004) Down-regulation of caveolin-1 in glioma vasculature: modulation by radiotherapy. J Neurosci. Res. 75:291-299.
- Gingras D, Labelle D, Carine N, Boivin D, Demeule M, Barthomeuf C and Béliveau R (2004) The antiangiogenic agent Neovastat (AE-941) stimulates tissue plasminogen activator activity. Invest. New drugs. 22:17-26.
- Turcotte S, Desrosiers RR and Béliveau R (2004) Hypoxia upregulates von Hippel-Lindau tumor-suppressor protein through RhoA-dependent activity in renal cell carcinoma. Am J Physiol Renal Physiol. 286:F338-F348.
- Gingras D, Gendron M, Boivin D, Moghrabi A, Théoret Y and Béliveau R (2004) Induction of medulloblastoma cell apoptosis by sulforaphane, a dietary anticarcinogen from Brassica vegetables. Cancer Lett. 203:35-43.
- Langlois S, Gingras D and Béliveau R (2004) Membrane type 1-matrix metalloproteinase (MT1-MMP) cooperates with sphingosine 1-phosphate to induce endothelial cell migration and morphegenic differentiation. Blood 103:3020-3028.
- Annabi B, Thibeault S, Moumdjian R and Béliveau R (2004) Hyaluronan cell surface binding Is induced by type I collagen and regulated by caveolae in glioma cells J. Biol. Chem., 279: 21888 - 21896.
- Gingras D, Nyalendo C, Di Tomasso G, Annabi B and Béliveau R (2004) Activation of tissue plasminogen activator gene transcription by Neovastat, a multifunctional antiangiogenic agent. Biochem. Biophys. Res Commun. 320:205-212.
- Lacourcière Y, Béliveau R, Conter HS, Burgess ED, Lepage S, Pesant Y, Spence JD, Asmar R, Carrière S, Plante GE (2004) Canadian Hypertension Society. Effects of perindopril on elastic and structural properties of large arteries in essential hypertension. Can J Cardiol 20(8):795-799.
- Béliveau R and Gingras D (2004) Green tea: prevention and treatment of cancer by nutraceuticals. Lancet364:1021-2.
- Turcotte S, Desrosiers RR, Brand G and Béliveau R (2004) Hypoxia upregulates von Hippel-Lindau tumor suppressor protein stimulation by thrombin involves RhoA activation. Int. J. Cancer 112: 777-786.
- Demeule M, Regina A, Annabi B, Bertrand Y, Bojanowky and Béliveau R (2004) Brain endothelial cells as pharmacological targets in brain tumors. Mol Neurobiol. 30:157-184.
- Laplante I, Béliveau R, Paquin J (2004) RhoA/ROCK and Cdc42 regulate cell-cell contact and N-cadherin protein level during neurodetermination of P19 embryonal stem cells. J Neurobiol 60:289-307.
- Demeule M, Brossard M, Turcotte S, Regina A, Jodoin J, Béliveau R (2004) Diallyl dusulfide a chemopreventive agent in garlic induces multidrug-resistance associated protein 2 expression Biochem Biophys Res Comm 324: 937-945.
- Caron A, Desrosiers RR, Béliveau R (2004) Kidney ischemia-reperfusion regulates expression and distribution of tubulin subunits, beta-actin and rho GTPases in proximal tubules. Arch Biochem Biophys 431:31-46.
- Boivin D, Provençal M, Gendron S, Ratel D, Demeule M, Gingras D, and Béliveau R (2004) Purification and characterization of a stimulator of plasmin generation from the antiangiogenic agent Neovastat: identification as immunoglobulin Kappa light chain. Arch. Biochem. Biophys. 431 :197-206.
- Barthomeuf C, Boivin D, Béliveau R (2004) Inhibition of HUVEC tubulogenesis by hederacolchiside-A1 is associated with plasma membrane cholesterol sequestration and activation of Ha-Ras/MEK/ERK cascade. Cancer Chemother Pharmacol. 54:432-440.
1.
L. N. Kolonel, D. Altshuler, and B. E. Henderson. Estudo coorte multiétnico: explorando genes, estilo de vida e risco de câncer. Nat. Rev. Cancer. 4:519–27 (2004) doi:10.1038/nrc1389. [PubMed].
2.
J. K. Wiencke. Impacto da raça/ etnicidade sobre as vias moleculares em câncer humano. Nat. Rev. Cancer. 4:79–84 (2004) doi:10.1038/nrc1257. [PubMed].
3.
R. G. Ziegler, R. N. Hoover, M. C. Pike, A. Hildesheim, A. M. Nomura, D. W. West, A. H. Wu-Williams, L. N. Kolonel, P. L. Horn-Ross, J. F. Rosenthal, and M. B. Hyer. Padrões migratórios e risco de câncer de mama em mulheres asiático-americanas. J. Natl. Cancer Inst.85:1819–27 (1993) doi:10.1093/jnci/85.22.1819. [PubMed].
4.
W. Haenszel and M. Kurihara. Studies of Japanese migrants. I. Mortality from cancer and other diseases among Japanese in the United States. J. Natl. Cancer Inst.40:43–68 (1968). [PubMed].
5.
A. S. Hamilton and T. M. Mack. Puberty and genetic susceptibility to breast cancer in a case-control study in twins. N. Engl. J. Med.348:2313–22 (2003) doi:10.1056/NEJMoa021293. [PubMed].
6.
A. Jemal, R. Siegel, E. Ward, T. Murray, J. Xu, and M. J. Thun. Cancer statistics, 2007. CA Cancer J. Clin.57:43–66 (2007). [PubMed].
7.
F. Brayand, and B. Moller. Predicting the future burden of cancer. Nat. Rev. Cancer. 6:63–74 (2006) doi:10.1038/nrc1781. [PubMed].
8.
P. Lichtenstein, N. V. Holm, P. K. Verkasalo, A. Iliadou, J. Kaprio, M. Koskenvuo, E. Pukkala, A. Skytthe, and K. Hemminki. Environmental and heritable factors in the causation of cancer—analyses of cohorts of twins from Sweden, Denmark, and Finland. N. Engl. J. Med.343:78–85 (2000) doi:10.1056/NEJM200007133430201. [PubMed].
9.
K. R. Loeb, and L. A. Loeb. Significance of multiple mutations in cancer. Carcinogenesis. 21:379–85 (2000) doi:10.1093/carcin/21.3.379. [PubMed].
10.
W. C. Hahn, and R. A. Weinberg. Modelling the molecular circuitry of cancer. Nat. Rev. Cancer. 2:331–41 (2002) doi: 10.1038/nrc795. [PubMed].
11.
L. A. Mucci, S. Wedren, R. M. Tamimi, D. Trichopoulos, and H. O. Adami. The role of gene-environment interaction in the aetiology of human cancer: examples from cancers of the large bowel, lung and breast. J. Intern. Med.249:477–93 (2001) doi:10.1046/j.1365-2796.2001.00839.x. [PubMed].
12.
K. Czene, and K. Hemminki. Kidney cancer in the Swedish Family Cancer Database: familial risks and second primary malignancies. Kidney Int.61:1806–13 (2002) doi:10.1046/j.1523-1755.2002.00304.x. [PubMed].
13.
P. Irigaray, J. A. Newby, R. Clapp, L. Hardell, V. Howard, L. Montagnier, S. Epstein, and D. Belpomme. Lifestyle-related factors and environmental agents causing cancer: an overview. Biomed. Pharmacother.61:640–58 (2007) doi:10.1016/j.biopha.2007.10.006. [PubMed].
14.
M. F. Denissenko, A. Pao, M. Tang, and G. P. Pfeifer. Preferential formation of benzo[a]pyrene adducts at lung cancer mutational hotspots in P53. Science. 274:430–2 (1996) doi:10.1126/science.274.5286.430. [PubMed].
15.
R. J. Anto, A. Mukhopadhyay, S. Shishodia, C. G. Gairola, and B. B. Aggarwal. Cigarette smoke condensate activates nuclear transcription factor-kappaB through phosphorylation and degradation of IkappaB(alpha): correlation with induction of cyclooxygenase-2. Carcinogenesis. 23:1511–8 (2002) doi: 10.1093/carcin/23.9.1511. [PubMed].
16.
S. Shishodiaand, and B. B. Aggarwal. Cyclooxygenase (COX)-2 inhibitor celecoxib abrogates activation of cigarette smoke-induced nuclear factor (NF)-kappaB by suppressing activation of IkappaBalpha kinase in human non-small cell lung carcinoma: correlation with suppression of cyclin D1, COX-2, and matrix metalloproteinase-9. Cancer Res. 64:5004–12 (2004) doi:10.1158/0008-5472.CAN-04-0206. [PubMed].
17.
H. Ichikawa, Y. Nakamura, Y. Kashiwada, and B. B. Aggarwal. Anticancer drugs designed by mother nature: ancient drugs but modern targets. Curr Pharm Des. 13:3400–16 (2007) doi:10.2174/138161207782360500. [PubMed].
18.
A. J. Tuyns. Epidemiology of alcohol and cancer. Cancer Res. 39:2840–3 (1979). [PubMed].
19.
H. Maier, E. Sennewald, G. F. Heller, and H. Weidauer. Chronic alcohol consumption—the key risk factor for pharyngeal cancer. Otolaryngol. Head Neck Surg.110:168–73 (1994). [PubMed].
20.
H. K. Seitz, F. Stickel, and N. Homann. Pathogenetic mechanisms of upper aerodigestive tract cancer in alcoholics. Int. J. Cancer. 108:483–7 (2004) doi:10.1002/ijc.11600. [PubMed].
21.
R. Doll, and R. Peto. The causes of cancer: quantitative estimates of avoidable risks of cancer in the United States today. J. Natl. Cancer Inst. 66:1191–308 (1981). [PubMed].
22.
R. R. Williams, and J. W. Horm. Association of cancer sites with tobacco and alcohol consumption and socioeconomic status of patients: interview study from the Third National Cancer Survey. J. Natl. Cancer Inst.58:525–47 (1977). [PubMed].
23.
N. Hamajima et al. Alcohol, tobacco and breast cancer—collaborative reanalysis of individual data from 53 epidemiological studies, including 58,515 women with breast cancer and 95,067 women without the disease. Br. J. Cancer. 87:1234–45 (2002) doi:10.1038/sj.bjc.6600596. [PubMed].
24.
M. P. Longnecker, P. A. Newcomb, R. Mittendorf, E. R. Greenberg, R. W. Clapp, G. F. Bogdan, J. Baron, B. MacMahon, and W. C. Willett. Risk of breast cancer in relation to lifetime alcohol consumption. J. Natl. Cancer Inst.87:923–9 (1995) doi:10.1093/jnci/87.12.923. [PubMed].
25.
F. Stickel, D. Schuppan, E. G. Hahn, and H. K. Seitz. Cocarcinogenic effects of alcohol in hepatocarcinogenesis. Gut. 51:132–9 (2002) doi:10.1136/gut.51.1.132. [PubMed].
26.
H. K. Seitz, G. Poschl, and U. A. Simanowski. Alcohol and cancer. Recent Dev Alcohol. 14:67–95 (1998) doi:10.1007/0-306-47148-5_4. [PubMed].
27.
H. K. Seitz, S. Matsuzaki, A. Yokoyama, N. Homann, S. Vakevainen, and X. D. Wang. Alcohol and cancer. Alcohol Clin. Exp. Res.25:137S–143S (2001). [PubMed].
28.
F. Donato, U. Gelatti, R. M. Limina, and G. Fattovich. Southern Europe as an example of interaction between various environmental factors: a systematic review of the epidemiologic evidence. Oncogene. 25:3756–70 (2006) doi:10.1038/sj.onc.1209557. [PubMed].
29.
G. Poschl, and H. K. Seitz. Alcohol and cancer. Alcohol Alcohol. 39:155–65 (2004) doi:10.1093/alcalc/agh057. [PubMed].
30.
G. Szabo, P. Mandrekar, S. Oak, and J. Mayerle. Effect of ethanol on inflammatory responses. Implications for pancreatitis. Pancreatology. 7:115–23 (2007) doi:10.1159/000104236. [PubMed].
31.
B. B. Aggarwal. Nuclear factor-kappaB: the enemy within. Cancer Cell. 6:203–208 (2004) doi:10.1016/j.ccr.2004.09.003. [PubMed].
32.
M. Kuratsune, S. Kohchi, and A. Horie. Carcinogenesis in the esophagus. I. Penetration of benzo(a) pyrene and other hydrocarbons into the esophageal mucosa. Gann. 56:177–87 (1965). [PubMed].
33.
C. La Vecchia, A. Tavani, S. Franceschi, F. Levi, G. Corrao, and E. Negri. Epidemiology and prevention of oral cancer. Oral Oncol.33:302–312 (1997). [PubMed].
34.
P. Boffetta, M. Hashibe, C. La Vecchia, W. Zatonski, and J. Rehm. The burden of cancer attributable to alcohol drinking. Int. J. Cancer. 119:884–887 (2006) doi:10.1002/ijc.21903. [PubMed].
35.
W. C. Willett. Diet and cancer. Oncologist. 5:393–404 (2000) doi:10.1634/theoncologist.5-5-393. [PubMed].
36.
S. A. Bingham, R. Hughes, and A. J. Cross. Effect of white versus red meat on endogenous N-nitrosation in the human colon and further evidence of a dose response. J. Nutr.132:3522S–3525S (2002). [PubMed].
37.
A. Chao, M. J. Thun, C. J. Connell, M. L. McCullough, E. J. Jacobs, W. D. Flanders, C. Rodriguez, R. Sinha, and E. E. Calle. Meat consumption and risk of colorectal cancer. JAMA. 293:172–182 (2005) doi:10.1001/jama.293.2.172. [PubMed].
38.
N. Hogg. Red meat and colon cancer: heme proteins and nitrite in the gut. A commentary on diet-induced endogenous formation of nitroso compounds in the GI tract. Free Radic. Biol. Med.43:1037–1039 (2007) doi:10.1016/j.freeradbiomed.2007.07.006. [PubMed].
39.
C. Rodriguez, M. L. McCullough, A. M. Mondul, E. J. Jacobs, A. Chao, A. V. Patel, M. J. Thun, and E. E. Calle. Meat consumption among Black and White men and risk of prostate cancer in the Cancer Prevention Study II Nutrition Cohort. Cancer Epidemiol. Biomarkers Prev. 15:211–216 (2006) doi:10.1158/1055-9965.EPI-05-0614. [PubMed].
40.
R. Garcia-Closas, M. Garcia-Closas, M. Kogevinas, N. Malats, D. Silverman, C. Serra, A. Tardon, A. Carrato, G. Castano-Vinyals, M. Dosemeci, L. Moore, N. Rothman, and R. Sinha. Food, nutrient and heterocyclic amine intake and the risk of bladder cancer. Eur. J. Cancer. 43:1731–1740 (2007) doi:10.1016/j.ejca.2007.05.007. [PubMed].
41.
A. Tappel. Heme of consumed red meat can act as a catalyst of oxidative damage and could initiate colon, breast and prostate cancers, heart disease and other diseases. Med. Hypotheses. 68:562–4 (2007) doi:10.1016/j.mehy.2006.08.025. [PubMed].
42.
L. H. O’Hanlon. High meat consumption linked to gastric-cancer risk. Lancet Oncol. 7:287 (2006) doi:10.1016/S1470-2045(06)70638-6. [PubMed].
43.
T. N. Toporcov, J. L. Antunes, and M. R. Tavares. Fat food habitual intake and risk of oral cancer. Oral Oncol. 40:925–931 (2004) doi:10.1016/j.oraloncology.2004.04.007. [PubMed].
44.
O. Dosil-Diaz, A. Ruano-Ravina, J. J. Gestal-Otero, and J. M. Barros-Dios. Meat and fish consumption and risk of lung cancer: A case-control study in Galicia, Spain. Cancer Lett.252:115–122 (2007) doi:10.1016/j.canlet.2006.12.008. [PubMed].
45.
S. N. Lauber, and N. J. Gooderham. The cooked meat derived genotoxic carcinogen 2-amino-3-methylimidazo[4,5-b]pyridine has potent hormone-like activity: mechanistic support for a role in breast cancer. Cancer Res.67:9597–0602 (2007) doi:10.1158/0008–5472.CAN-07-1661. [PubMed].
46.
D. Divisi, S. Di Tommaso, S. Salvemini, M. Garramone, and R. Crisci. Diet and cancer. Acta Biomed. 77:118–123 (2006). [PubMed].
47.
Y. F. Sasaki, S. Kawaguchi, A. Kamaya, M. Ohshita, K. Kabasawa, K. Iwama, K. Taniguchi, and S. Tsuda. The comet assay with 8 mouse organs: results with 39 currently used food additives. Mutat. Res.519:103–119 (2002). [PubMed].
48.
M. Durando, L. Kass, J. Piva, C. Sonnenschein, A. M. Soto, E. H. Luque, and M. Munoz-de-Toro. Prenatal bisphenol A exposure induces preneoplastic lesions in the mammary gland in Wistar rats. Environ. Health Perspect.115:80–6 (2007). [PubMed].
49.
S. M. Ho, W. Y. Tang, J. Belmonte de Frausto, and G. S. Prins. Developmental exposure to estradiol and bisphenol A increases susceptibility to prostate carcinogenesis and epigenetically regulates phosphodiesterase type 4 variant 4. Cancer Res.66:5624–32 (2006) doi:10.1158/0008-5472.CAN-06-0516. [PubMed].
50.
A. Szymanska-Chabowska, J. Antonowicz-Juchniewicz, and R. Andrzejak. Some aspects of arsenic toxicity and carcinogenicity in living organism with special regard to its influence on cardiovascular system, blood and bone marrow. Int. J. Occup. Med. Environ. Health. 15:101–116 (2002). [PubMed].
51.
E. E. Calle, C. Rodriguez, K. Walker-Thurmond, and M. J. Thun. Overweight, obesity, and mortality from cancer in a prospectively studied cohort of U.S. adults. N Engl J Med. 348:1625–1638 (2003) doi:10.1056/NEJMoa021423. [PubMed].
52.
A. Drewnowski, and B. M. Popkin. The nutrition transition: new trends in the global diet. Nutr. Rev.55:31–43 (1997). [PubMed].
53.
S. D. Hursting, L. M. Lashinger, L. H. Colbert, C. J. Rogers, K. W. Wheatley, N. P. Nunez, S. Mahabir, J. C. Barrett, M. R. Forman, and S. N. Perkins. Energy balance and carcinogenesis: underlying pathways and targets for intervention. Curr. Cancer Drug Targets. 7:484–491 (2007) doi:10.2174/156800907781386623. [PubMed].
54.
A. Nareika, Y. B. Im, B. A. Game, E. H. Slate, J. J. Sanders, S. D. London, M. F. Lopes-Virella, and Y. Huang. High glucose enhances lipopolysaccharide-stimulated CD14 expression in U937 mononuclear cells by increasing nuclear factor kappaB and AP-1 activities. J. Endocrinol.196:45–55 (2008) doi:10.1677/JOE-07-0145. [PubMed].
55.
C. H. Tang, Y. C. Chiu, T. W. Tan, R. S. Yang, and W. M. Fu. Adiponectin enhances IL-6 production in human synovial fibroblast via an AdipoR1 receptor, AMPK, p38, and NF-kappa B pathway. J. Immunol.179:5483–5492 (2007). [PubMed].
56.
P. Pisani, D. M. Parkin, N. Munoz, and J. Ferlay. Cancer and infection: estimates of the attributable fraction in 1990. Cancer Epidemiol. Biomarkers Prev.6:387–400 (1997). [PubMed].
57.
D. M. Parkin. The global health burden of infection-associated cancers in the year 2002. Int. J. Cancer. 118:3030–3044 (2006) doi:10.1002/ijc.21731. [PubMed].
58.
S. Song, H. C. Pitot, and P. F. Lambert. The human papillomavirus type 16 E6 gene alone is sufficient to induce carcinomas in transgenic animals. J. Virol.73:5887–5893 (1999). [PubMed].
59.
B. S. Blumberg, B. Larouze, W. T. London, B. Werner, J. E. Hesser, I. Millman, G. Saimot, and M. Payet. The relation of infection with the hepatitis B agent to primary hepatic carcinoma. Am. J. Pathol.81:669–682 (1975). [PubMed].
60.
T. M. Hagen, S. Huang, J. Curnutte, P. Fowler, V. Martinez, C. M. Wehr, B. N. Ames, and F. V. Chisari. Extensive oxidative DNA damage in hepatocytes of transgenic mice with chronic active hepatitis destined to develop hepatocellular carcinoma. Proc. Natl. Acad. Sci. U S A. 91:12808–12812 (1994) doi:10.1073/pnas.91.26.12808. [PubMed].
61.
A. L. Jackson, and L. A. Loeb. The contribution of endogenous sources of DNA damage to the multiple mutations in cancer. Mutat. Res.477:7–21 (2001) doi:10.1016/S0027-5107(01)00091-4. [PubMed].
62.
N. De Maria, A. Colantoni, S. Fagiuoli, G. J. Liu, B. K. Rogers, F. Farinati, D. H. Van Thiel, and R. A. Floyd. Association between reactive oxygen species and disease activity in chronic hepatitis C. Free Radic. Biol. Med.21:291–5 (1996) doi:10.1016/0891–5849(96)00044-5. [PubMed].
63.
K. Koike, T. Tsutsumi, H. Fujie, Y. Shintani, and M. Kyoji. Molecular mechanism of viral hepatocarcinogenesis. Oncology. 62(Suppl 1):29–37 (2002) doi:10.1159/000048273. [PubMed].
64.
D. Belpomme, P. Irigaray, L. Hardell, R. Clapp, L. Montagnier, S. Epstein, and A. J. Sasco. The multitude and diversity of environmental carcinogens. Environ. Res.105:414–429 (2007) doi:10.1016/j.envres.2007.07.002. [PubMed].
65.
Y. S. Guan, Q. He, M. Q. Wang, and P. Li. Nuclear factor kappa B and hepatitis viruses. Expert Opin. Ther. Targets. 12:265–280 (2008) doi:10.1517/14728222.12.3.265. [PubMed].
66.
S. Takayama, H. Takahashi, Y. Matsuo, Y. Okada, and T. Manabe. Effects of Helicobacter pylori infection on human pancreatic cancer cell line. Hepatogastroenterology. 54:2387–2391 (2007). [PubMed].
67.
K. A. Steinmetz, and J. D. Potter. Vegetables, fruit, and cancer prevention: a review. J. Am. Diet Assoc.96:1027–1039 (1996) doi:10.1016/S0002–8223(96)00273-8. [PubMed].
68.
P. Greenwald. Lifestyle and medical approaches to cancer prevention. Recent Results Cancer Res.166:1–15 (2005). [PubMed].
69.
H. Vainio, and E. Weiderpass. Fruit and vegetables in cancer prevention. Nutr. Cancer. 54:111–42 (2006) doi:10.1207/s15327914nc5401_13. [PubMed].
70.
L. W. Wattenberg. Chemoprophylaxis of carcinogenesis: a review. Cancer Res. 26:1520–1526 (1966). [PubMed].
71.
B. B. Aggarwal, and S. Shishodia. Molecular targets of dietary agents for prevention and therapy of cancer. Biochem. Pharmacol.71:1397–1421 (2006) doi:10.1016/j.bcp.2006.02.009. [PubMed].
72.
H. Nishino, M. Murakosh, T. Ii, M. Takemura, M. Kuchide, M. Kanazawa, X. Y. Mou, S. Wada, M. Masuda, Y. Ohsaka, S. Yogosawa, Y. Satomi, and K. Jinno. Carotenoids in cancer chemoprevention. Cancer Metastasis Rev.21:257–264 (2002) doi:10.1023/A:1021206826750. [PubMed].
73.
K. B. Harikumar, and B. B. Aggarwal. Resveratrol: A multitargeted agent for age-associated chronic diseases. Cell Cycle. 7:1020–1037 (2008). [PubMed].
74.
G. L. Russo. Ins and outs of dietary phytochemicals in cancer chemoprevention. Biochem. Pharmacol. 74:533–544 (2007) doi:10.1016/j.bcp.2007.02.014. [PubMed].
75.
R. Agarwal, C. Agarwal, H. Ichikawa, R. P. Singh, and B. B. Aggarwal. Anticancer potential of silymarin: from bench to bed side. Anticancer Res. 26:4457–98 (2006). [PubMed].
76.
E. G. Rogan. The natural chemopreventive compound indole-3-carbinol: state of the science. In Vivo. 20:221–228 (2006). [PubMed].
77.
N. Juge, R. F. Mithen, and M. Traka. Molecular basis for chemoprevention by sulforaphane: a comprehensive review. Cell Mol Life Sci. 64:1105–27 (2007) doi:10.1007/s00018-007-6484-5. [PubMed].
78.
L. Chen, and H. Y. Zhang. Cancer preventive mechanisms of the green tea polyphenol (−)-epigallocatechin-3-gallate. Molecules. 12:946–957 (2007). [PubMed].
79.
P. Anand, C. Sundaram, S. Jhurani, A. B. Kunnumakkara, and B. B. Aggarwal. Curcumin and cancer: An "old-age" disease with an "age-old" solution. Cancer Lett. in press (2008).
80.
F. Khanum, K. R. Anilakumar, and K. R. Viswanathan. Anticarcinogenic properties of garlic: a review. Crit. Rev. Food Sci. Nutr.44:479–488 (2004) doi:10.1080/10408690490886700. [PubMed].
81.
G. Sethi, K. S. Ahn and B. B. Aggarwal. Targeting NF-kB activation pathway by thymoquinone: Role in suppression of antiapoptotic gene products and enhancement of apoptosis. Mole Cancer Res. in press (2008).
82.
Y. J. Surh. Anti-tumor promoting potential of selected spice ingredients with antioxidative and anti-inflammatory activities: a short review. Food Chem. Toxicol.40:1091–1097 (2002) doi:10.1016/S0278-6915(02)00037-6. [PubMed].
83.
Y. Shukla, and M. Singh. Cancer preventive properties of ginger: a brief review. Food Chem. Toxicol.45:683–690 (2007) doi:10.1016/j.fct.2006.11.002. [PubMed].
84.
M. M. al-Harbi, S. Qureshi, M. Raza, M. M. Ahmed, A. B. Giangreco, and A. H. Shah. Influence of anethole treatment on the tumour induced by Ehrlich ascites carcinoma cells in paw of Swiss albino mice. Eur. J. Cancer Prev.4:307–318 (1995) doi:10.1097/00008469-199508000-00006. [PubMed].
85.
C. K. Sen, K. E. Traber, and L. Packer. Inhibition of NF-kappa B activation in human T-cell lines by anetholdithiolthione. Biochem. Biophys. Res. Commun.218:148–53 (1996) doi:10.1006/bbrc.1996.0026. [PubMed].
86.
R. A. Lubet, V. E. Steele, I. Eto, M. M. Juliana, G. J. Kelloff, and C. J. Grubbs. Chemopreventive efficacy of anethole trithione, N-acetyl-L-cysteine, miconazole and phenethylisothiocyanate in the DMBA-induced rat mammary cancer model. Int. J. Cancer. 72:95–101 (1997) doi:10.1002/(SICI)1097-0215(19970703)72:1<95::aid-ijc14>3.0.CO;2-9. [PubMed].
87.
Y. Nakagawa, and T. Suzuki. Cytotoxic and xenoestrogenic effects via biotransformation of trans-anethole on isolated rat hepatocytes and cultured MCF-7 human breast cancer cells. Biochem. Pharmacol.66:63–73 (2003) doi:10.1016/S0006-2952(03)00208-9. [PubMed].
88.
S. Lam, C. MacAulay, J. C. Le Riche, Y. Dyachkova, A. Coldman, M. Guillaud, E. Hawk, M. O. Christen, and A. F. Gazdar. A randomized phase IIb trial of anethole dithiolethione in smokers with bronchial dysplasia. J. Natl. Cancer Inst.94:1001–1009 (2002). [PubMed].
89.
S. Shishodia, and B. B. Aggarwal. Diosgenin inhibits osteoclastogenesis, invasion, and proliferation through the downregulation of Akt, I kappa B kinase activation and NF-kappa B-regulated gene expression. Oncogene. 25:1463–1473 (2006) doi:10.1038/sj.onc.1209194. [PubMed].
90.
R. Ghosh, N. Nadiminty, J. E. Fitzpatrick, W. L. Alworth, T. J. Slaga, and A. P. Kumar. Eugenol causes melanoma growth suppression through inhibition of E2F1 transcriptional activity. J. Biol. Chem.280:5812–5819 (2005) doi:10.1074/jbc.M411429200. [PubMed].
91.
K. Sukumaran, M. C. Unnikrishnan, and R. Kuttan. Inhibition of tumour promotion in mice by eugenol. Indian J. Physiol. Pharmacol.38:306–308 (1994). [PubMed].
92.
K. Imaida, M. Hirose, S. Yamaguchi, S. Takahashi, and N. Ito. Effects of naturally occurring antioxidants on combined 1,2-dimethylhydrazine- and 1-methyl-1-nitrosourea-initiated carcinogenesis in F344 male rats. Cancer Lett.55:53–59 (1990) doi:10.1016/0304-3835(90)90065-6. [PubMed].
93.
M. Pisano, G. Pagnan, M. Loi, M. E. Mura, M. G. Tilocca, G. Palmieri, D. Fabbri, M. A. Dettori, G. Delogu, M. Ponzoni, and C. Rozzo. Antiproliferative and pro-apoptotic activity of eugenol-related biphenyls on malignant melanoma cells. Mol Cancer. 6:8 (2007) doi:10.1186/1476-4598-6-8. [PubMed].
94.
S. S. Kim, O. J. Oh, H. Y. Min, E. J. Park, Y. Kim, H. J. Park, Y. Nam Han, and S. K. Lee. Eugenol suppresses cyclooxygenase-2 expression in lipopolysaccharide-stimulated mouse macrophage RAW264.7 cells. Life Sci. 73:337–348 (2003) doi:10.1016/S0024–3205(03)00288-1. [PubMed].
95.
H. P. Deigner, G. Wolf, U. Ohlenmacher, and J. Reichling. 1¢-Hydroxyeugenol- and coniferyl alcohol derivatives as effective inhibitors of 5-lipoxygenase and Cu(2+)-mediated low density lipoprotein oxidation. Evidence for a dual mechanism. Arzneimittelforschung. 44:956–961 (1994). [PubMed].
96.
C. J. Rompelberg, M. J. Steenwinkel, J. G. van Asten, J. H. van Delft, R. A. Baan, and H. Verhagen. Effect of eugenol on the mutagenicity of benzo[a]pyrene and the formation of benzo[a]pyrene-DNA adducts in the lambda-lacZ-transgenic mouse. Mutat. Res.369:87–96 (1996) doi:10.1016/S0165-1218(96)90052-X. [PubMed].
97.
D. P. Richardson. The grain, the wholegrain and nothing but the grain: the science behind wholegrain and the reduced risk of heart disease and cancer. Nutr. Bull.25:353–360 (2000) doi:10.1046/j.1467-3010.2000.00083.x.
98.
H. E. Miller, F. Rigelhof, L. Marquart, A. Prakash, and M. Kanter. Antioxidant content of whole grain breakfast cereals, fruits and vegetables. J. Am. Coll. Nutr.19:312S–319S (2000). [PubMed].
99.
J. L. Slavin, D. Jacobs, and L. Marquart. Grain processing and nutrition. Crit. Rev. Food Sci. Nutr.40:309–326 (2000) doi:10.1080/10408690091189176. [PubMed].
100.
L. Chatenoud, A. Tavani, C. La Vecchia, D. R. Jacobs, Jr, E. Negri, F. Levi, and S. Franceschi. Whole grain food intake and cancer risk. Int. J. Cancer. 77:24–8 (1998) doi:10.1002/(SICI)1097-0215(19980703)77:1<24::aid-ijc5>3.0.CO;2-1. [PubMed].
101.
D. R. Jacobs, Jr, L. Marquart, J. Slavin, and L. H. Kushi. Whole-grain intake and cancer: an expanded review and meta-analysis. Nutr. Cancer. 30:85–96 (1998). [PubMed].
102.
L. Marquart, K. L. Wiemer, J. M. Jones, and B. Jacob. Whole grains health claims in the USA and other efforts to increase whole-grain consumption. Proc. Nutr. Soc.62:151–160 (2003) doi:10.1079/PNS2003242. [PubMed].
103.
M. Eastwood, and D. Kritchevsky. Dietary fiber: how did we get where we are? Annu. Rev. Nutr.25:1–8 (2005) doi:10.1146/annurev.nutr.25.121304.131658. [PubMed].
104.
A. McIntyre, P. R. Gibson, and G. P. Young. Butyrate production from dietary fibre and protection against large bowel cancer in a rat model. Gut. 34:386–391 (1993) doi:10.1136/gut.34.3.386. [PubMed].
105.
J. L. Slavin, D. Jacobs, L. Marquart, and K. Wiemer. The role of whole grains in disease prevention. J. Am. Diet Assoc.101:780–5 (2001) doi:10.1016/S0002-8223(01)00194-8. [PubMed].
106.
K. S. Ahn, G. Sethi, K. Krishnan, and B. B. Aggarwal. Gamma-tocotrienol inhibits nuclear factor-kappaB signaling pathway through inhibition of receptor-interacting protein and TAK1 leading to suppression of antiapoptotic gene products and potentiation of apoptosis. J. Biol. Chem.282:809–820 (2007) doi:10.1074/jbc.M610028200. [PubMed].
107.
F. H. Sarkar, S. Adsule, S. Padhye, S. Kulkarni, and Y. Li. The role of genistein and synthetic derivatives of isoflavone in cancer prevention and therapy. Mini Rev. Med. Chem.6:401–407 (2006) doi:10.2174/138955706776361439. [PubMed].
108.
K. W. Lee, H. J. Lee, Y. J. Surh, and C. Y. Lee. Vitamin C and cancer chemoprevention: reappraisal. Am. J. Clin. Nutr.78:1074–1078 (2003). [PubMed].
109.
B. A. Ingraham, B. Bragdon, and A. Nohe. Molecular basis of the potential of vitamin D to prevent cancer. Curr. Med. Res. Opin.24:139–149 (2008) doi:10.1185/030079907X253519. [PubMed].
110.
F. W. Booth, M. V. Chakravarthy, S. E. Gordon, and E. E. Spangenburg. Waging war on physical inactivity: using modern molecular ammunition against an ancient enemy. J. Appl. Physiol.93:3–30 (2002). [PubMed].
111.
G. A. Colditz, C. C. Cannuscio, and A. L. Frazier. Physical activity and reduced risk of colon cancer: implications for prevention. Cancer Causes Control. 8:649–67 (1997) doi:10.1023/A:1018458700185. [PubMed].
112.
A. R. Shors, C. Solomon, A. McTiernan, and E. White. Melanoma risk in relation to height, weight, and exercise (United States). Cancer Causes Control. 12:599–606 (2001) doi:10.1023/A:1011211615524. [PubMed].
113.
A. Tannenbaum, and H. Silverstone. The initiation and growth of tumors. Introduction. I. Effects of underfeeding. Am. J. Cancer. 38:335–350 (1940).
114.
S. D. Hursting, J. A. Lavigne, D. Berrigan, S. N. Perkins, and J. C. Barrett. Calorie restriction, aging, and cancer prevention: mechanisms of action and applicability to humans. Annu. Rev. Med.54:131–152 (2003) doi:10.1146/annurev.med.54.101601.152156. [PubMed].
115.
M. H. Ross, and G. Bras. Lasting influence of early caloric restriction on prevalence of neoplasms in the rat. J. Natl. Cancer Inst.47:1095–1113 (1971). [PubMed].
116.
D. Albanes. Total calories, body weight, and tumor incidence in mice. Cancer Res.47:1987–92 (1987). [PubMed].
117.
L. Gross, and Y. Dreyfuss. Reduction in the incidence of radiation-induced tumors in rats after restriction of food intake. Proc. Natl. Acad. Sci. U S A. 81:7596–7598 (1984) doi:10.1073/pnas.81.23.7596. [PubMed].
118.
L. Gross, and Y. Dreyfuss. Prevention of spontaneous and radiation-induced tumors in rats by reduction of food intake. Proc. Natl. Acad. Sci. U S A. 87:6795–6797 (1990) doi:10.1073/pnas.87.17.6795. [PubMed].
119.
K. Yoshida, T. Inoue, K. Nojima, Y. Hirabayashi, and T. Sado. Calorie restriction reduces the incidence of myeloid leukemia induced by a single whole-body radiation in C3H/He mice. Proc. Natl. Acad. Sci. U S A. 94:2615–2619 (1997) doi:10.1073/pnas.94.6.2615. [PubMed].
120.
V. D. Longo, and C. E. Finch. Evolutionary medicine: From dwarf model systems to healthy centenarians? Science. 299:1342–1346 (2003) doi:10.1126/science.1077991. [PubMed].
O Câncer é uma Doença Evitável que Exige Mudanças Importantes no Estilo de Vida.
Preetha Anand,1 Ajaikumar B. Kunnumakara,1 Chitra Sundaram,1 Kuzhuvelil B. Harikumar,1 Sheeja T. Tharakan,1 Oiki S. Lai,1 Bokyung Sung,1 and Bharat B. Aggarwal1,2
Recebido em 14 de maio de 2008; aceito em 9 de junho de 2008; publicado online em 15 de julho de 2008.
Resumo
Este ano, mais de 1 milhão de americanos e mais de 10 milhões de pessoas no mundo é esperado serem diagnosticados com câncer, uma doença que normalmente, crê-se ser evitável. Somente de 5–10% de todos os casos de câncer são atribuídos a defeitos genéticos, considerando que o restante, 90-95%, têm suas raízes no ambiente e estilo de vida. Os fatores do estilo vida incluem fumaça do cigarro, alimentação (frituras, carne vermelha), álcool, exposição solar, poluição ambiental, infecções, estresse, obesidade e sedentarismo. Evidências indicam que de todas as mortes relacionadas com câncer, aproximadamente de 25-30% são devido a infecções. A percentagem restante é de outros fatores ligados a radiação, estresse, atividade física, poluição ambiental, etc. Portanto, a prevenção do câncer requer parar de fumar, aumentar a ingestão de frutas e vegetais, uso moderado de álcool, restrição calórica, exercício, evitar exposição direta a luz solar,diminuir o consumo de carne, uso de grãos integrais, uso de vacinas e exames regulares. Nesta revisão, apresentamos evidências de a inflamação é o link entre fatores/agentes que causam câncer e os agentes que o previnem. Além disso, damos evidências de que o câncer é uma doença evitável que requer importantes mudanças no estilo de vida.
Abstract
This year, more than 1 million Americans and more than 10 million people worldwide are expected to be diagnosed with cancer, a disease commonly believed to be preventable. Only 5–10% of all cancer cases can be attributed to genetic defects, whereas the remaining 90–95% have their roots in the environment and lifestyle. The lifestyle factors include cigarette smoking, diet (fried foods, red meat), alcohol, sun exposure, environmental pollutants, infections, stress, obesity, and physical inactivity. The evidence indicates that of all cancer-related deaths, almost 25–30% are due to tobacco, as many as 30–35% are linked to diet, about 15–20% are due to infections, and the remaining percentage are due to other factors like radiation, stress, physical activity, environmental pollutants etc. Therefore, cancer prevention requires smoking cessation, increased ingestion of fruits and vegetables, moderate use of alcohol, caloric restriction, exercise, avoidance of direct exposure to sunlight, minimal meat consumption, use of whole grains, use of vaccinations, and regular check-ups. In this review, we present evidence that inflammation is the link between the agents/factors that cause cancer and the agents that prevent it. In addition, we provide evidence that cancer is a preventable disease that requires major lifestyle changes.
DESCRITORES: Câncer; fatores de risco ambientais; fatores de risco genéticos; prevenção.
INTRODUÇÃO
Depois de ter sequenciado seu próprio genoma, o pesquisador pioneiro do genoma, Craig Venter, fez a seguinte observação à frente da a conferência do século XXI, “A biologia humana é atualmente mais complicada do que se possa imaginar. Todo mundo fala sobre os genes que receberam de seus pais, por um traço ou outro. Mas na verdade, esses genes têm muito pouco impacto sobre os resultados da vida. Nossa biologia é uma estrada tão complicada que se relaciona com centenas de milhares de fatores independentes. Os genes não são absolutamente o nosso destino. Eles podem nos dar informações úteis sobre o risco elevado de uma doença, mas em muitos casos eles não determinarão a causa atual da doença ou a incidência atual de alguém adquiri-la. A maior parte da biologia vem da interação complexa de todas as proteínas e células que trabalham com fatores ambientais, não conduzida diretamente pelo código genético”,
Esta declaração é muito importante porque analisa o genoma humano como solução para a maioria das doenças crônicas, incluindo diagnóstico, prevenção e tratamento do câncer. Isso é muito enfatizado no mundo atualmente.
Estudos observacionais, contudo, indicam que assim como migramos para um país ou outro, nossas chances de sermos diagnosticados com o máximo de doenças crônicas não é determinado pelo país de onde viemos, mas por aquele do qual migramos 1–4. Além disso, estudos com gêmeos idênticos sugerem que os genes não são a fonte da maioria das doenças crônicas. Por exemplo, a concordância entre gêmeos idênticos para câncer de mama, descobriu-se ser de apenas 20% 5. Ao contrário de nossos genes, nosso estilo de vida e o ambiente respondem por 90-95% da maioria de nossas doenças crônicas.
O câncer continua a ser um assassino mundial, apesar da enorme quantidade de pesquisa e os rápidos desenvolvimentos vistos durante a década passada. De acordo com estatísticas recentes, o câncer conta com aproximadamente 23 % do total de mortes nos EUA e é a segunda causa mais comum de morte, seguida pelas doenças do coração 6. As mortes relacionadas por doenças do coração, contudo, têm abruptamente diminuído tanto em populações idosas quanto em jovens nos EUA de 1975 até 2002. Em contraste, nenhuma diferença apreciável em taxas de mortes por câncer tem sido observada nos Estados Unidos 6.
Até 2020, espera-se que a população mundial aumente para 7,5 bilhões; deste número, serão diagnosticados aproximadamente 15 milhões de novos casos de câncer e 12 milhões de pacientes com câncer morrerão (7). Esta tendência da incidência de câncer e das taxas de mortalidade faz-nos lembrar novamente do acórdão do Dr. John Bailer, em maio de 1985, no Programa Nacional de Câncer dos EUA como “fracasso qualificado”. O acórdão feito 14 anos após a declaração oficial do presidente Nixon foi a “Guerra contra o Câncer”. Mesmo depois de um quarto de século de extensas pesquisas, pesquisadores ainda estão tentando determinar se o câncer é evitável e se perguntam: “Se ele é evitável, por que estamos perdendo a guerra contra o câncer?” Nesta revisão, tentamos responder esta pergunta analisando os fatores de risco potenciais do câncer e explorar nossas opiniões para modulação destes fatores de risco. O câncer é causado tanto por fatores intrínsecos (como mutações inerentes, hormônios e condições imunológicas) e fatores adquiridos/ambientais (como cigarro, dieta, radiação e organismos infecciosos; Fig 1). A ligação entre dieta e câncer é revelada por uma grande variação de taxas de cânceres específicos em vários países e pela mudança observada na incidência de câncer na migração. Por exemplo, os asiáticos demonstrou-se ter 25 vezes menos incidência de câncer de próstata e dez vezes menos incidência de câncer de mama do que os moradores dos países ocidentais; e as taxas destes cânceres aumenta substancialmente depois que os asiáticos migram para o ocidente.
(http://www.dietandcancerreportorg/?p=ER).
Fig. 1 O papel dos genes e do ambiente no desenvolvimento do câncer. A. A contribuição da porcentagem de fatores genéticos e ambientais para o câncer. A contribuição de fatores genéticos e fatores ambientais para risco de câncer é 5-10% e 90-95% (mais ...).
A importância dos fatores do estilo de vida no desenvolvimento do câncer também foi mostrada em estudos de gêmeos monozigóticos 8. Apenas 5-10% de todos os cânceres são devido a um defeito inerente do gene. Vários cânceres que estão ligados a defeitos genéticos são mostrados na Fig. 2. Embora todos eles sejam resultado de mutações múltiplas 9, 10, estas mutações são devido a interação com o meio ambiente 11, 12.
Genes associados com o risco de diferentes cânceres.
Estas observações indicam que muitos cânceres não são de origem herdada e que fatores do estilo de vida, como hábitos dietéticos, fumo, ingestão de álcool e infecções, têm uma influência profunda sobre seu desenvolvimento 13. Embora os fatores hereditários não possam ser modificados, os do estilo de vida e ambientais são potencialmente modificáveis. A menor influência hereditária do câncer e a natureza modificável dos fatores ambientais apontam para a previsibilidade do câncer. A importância dos fatores de estilo de vida que afetam a incidência e a mortalidade de câncer inclui tabaco, álcool, dieta, obesidade, agentes infecciosos, poluição ambiental e radiação.
FATORES DE RISCO DE CÂNCER
Tabaco
O tabagismo foi identificado em 1964 como a primeira causa de câncer de pulmão no SurgeonGeneral's Advisory Commission Report (http://profiles.nlm.nih.gov/NN/Views/AlphaChron/date/10006/05/01/2008), e desde então, contínuos esforços têm sido feitos para reduzir o uso do tabaco. O uso do cigarro aumenta o risco de desenvolver pelo menos 14 tipos de câncer (Fig. 3). Além disso, ele se relaciona com aproximadamente 25-30% de todas as mortes por câncer e 87% delas por câncer de pulmão. Comparado com os não fumantes, os homens tabagistas têm 23 vezes e as mulheres 17 vezes mais probabilidade em desenvolver câncer de pulmão (http://www.cancer.org/docroot/STT/content/STT_1x_Cancer_Facts_and_Figures_2008.asp accessed on 05/01/2008). Os efeitos carcinogênicos dos fumantes ativos são bem documentados; a Agência de Proteção Ambiental dos EUA, por exemplo, em 1993 classificou a fumaça do tabaco ambiental (dos fumantes passivos) como um conhecido carcinógeno do pulmão (Grupo A) (http://cfpub2.epa.gov/ncea/cfm/recordisplay.cfm?deid=2835 accessed on 05/01/2008). O tabaco contém pelo menos 50 carcinógenos. Por exemplo, um metabólico do tabaco, epóxido benzopirenóide, tem associação direta com o câncer de pulmão 14. Entre todos os países desenvolvidos considerados como um todo, a prevalência do tabagismo tem declinado lentamente; no entanto, em países desenvolvidos onde 85% da população mundial reside, a prevalência do fumo está aumentando. De acordo com estudos das recentes tendências ao uso do cigarro, os países em desenvolvimento consumirão 71% do tabaco mundial até 2010, com 80% do aumento desse consumo projetado para o Oriente Asiático (http://www.fao.org/DOCREP/006/Y4956E/Y4956E00.HTM accessed on 01/11/08). O uso acelerado de programas de controle do tabaco, com ênfase nas áreas onde o consumo está aumentando, será a única maneira de reduzir as taxas de mortes de câncer relacionadas ao tabaco.
Cânceres que são ligados ao tabagismo e ao álcool. Percentagens representam a mortalidade de câncer atribuída ao álcool e fumo em homens e mulheres como relatado por Irigaray et al. (veja 13).
De que forma o fumo contribui para o câncer não é totalmente compreendido. Sabemos que o fumo pode alterar um grande número de vias de sinalização de células. Resultados de estudos em nosso grupo estabeleceram uma ligação entre a fumaça de cigarro e a inflamação. Especificamente, mostramos que a fumaça de cigarro pode induzir a ativação do NF-κB, como marcador inflamatório 15,16. Com isso, agentes anti-inflamatórios que podem suprimir a ativação do NF-κB podem ter aplicações potenciais contra a fumaça do cigarro. Também mostramos que a curcumina, derivado dos temperos da dieta turmérica, pode bloquear a indução do NF-κB da fumaça do cigarro 15. Além da curcumina, descobrimos que muitos fitoquímicos naturais também inibem o NF-κB induzido por vários carcinógenos 17. Portanto, os efeitos carcinogênicos do tabaco parecem ser reduzidos por estes agentes dietéticos. Uma discussão mais detalhada de agentes dietéticos que podem bloquear a inflamação e, assim, prover efeitos quimopreventivos são apresentados na seção seguinte.
Álcool
O primeiro relato da associação entre álcool e um risco elevado de câncer de esôfago foi publicado em 1910 18. Desde então, uma variedade de estudos têm revelado que o consumo crônico de álcool é um fator de risco para cânceres do trato digestivo superior, incluindo cânceres da cavidade oral, faringe, hipofaringe, laringe e esôfago 18–21, assim como para cânceres do fígado, pâncreas, boca e mama (Fig. 3). Williams e Horn 22, por exemplo, relataram um risco elevado de câncer de mama por causa do álcool. Em contrapartida, um grupo colaborativo que estudou fatores hormonais no câncer de mama publicou suas descobertas de uma re-análise em mais de 80% de estudos epidemiológicos individuais que foram conduzidos no mundo sobre a associação entre álcool e o risco de câncer de mama em mulheres. Sua análise mostrou um aumento do risco relativo do câncer de mama de 7,1% para cada 10 g/dia adicional de ingestão de álcool 23. Outro estudo, Longnecker et al., 24 demonstrou que 4% de todos os novos casos de câncer de mama nos EUA são devido ao uso de álcool. Além de ser um risco para câncer de mama, a ingestão abusiva de álcool (mais de 50-70 g/dia) é um fator de risco bem estabelecido para os cânceres de fígado e colo-retal 26,27.
Há também evidência de um efeito sinérgico entre a ingestão abusiva de álcool e o vírus da hepatite C (HCV) ou da hepatite B (HBV), que provavelmente aumenta o risco de carcinoma hepatocelular (HCC) por promover cirrose de forma ativa. Por exemplo, Donato et al. 28 relatou que entre os bebedores de álcool, o risco de HCC aumenta linearmente com uma ingestão diária de mais de 60 g. Contudo, com a presença concomitante da infecção do HCV, o risco de HCC foi duas vezes maior do que a observada com o uso isolado (ou seja, um efeito sinérgico positivo). A relação entre álcool e inflamação foi também estabelecido, especialmente em termos da inflamação do fígado induzido por álcool.
Como o álcool participa na carcinogênese não está totalmente compreendido, mas o etanol pode assumir o papel 29. Especificamente, quando o etanol é metabolizado, acetaldeído e radicais livres são produzidos; acredita-se que os radicais livres sejam predominantemente responsáveis pela carcinogênese associada ao álcool através de sua ligação com DNA e proteínas, as quais destroem o folato resultando em hiper proliferação secundária. Outros mecanismos pelos quais o álcool estimula a carcinogênese incluem a indução do citocromo P-4502E1, o qual está associado ao aumento da produção de radicais livres e na ativação de vários pró-carcinógenos presentes em bebidas alcoólicas; uma mudança no metabolismo e na distribuição de carcinógenos, em associação com a fumaça do cigarro e dieta; alterações no comportamento do ciclo celular, tal como a duração, levando a hiperproliferação; deficiências nutricionais, por exemplo, de metila, vitamina E, folato, fosfato de piridoxal, zinco e selênio e alterações do sistema imunológico. Lesão tissular, como a que ocorre na cirrose hepática, é um importante pré-requisito para o HCC. Além disso, o álcool pode ativar o trajeto do pró-inflamatório NF-κB 30, que também pode contribuir para a tumorogênese 31. Além disso, mostrou-se que o benzopireno, um carcinógeno da fumaça do cigarro, pode penetrar o esôfago quando combinado com o etanol 32. Portanto, os agentes anti-inflamatórios podem ser efetivos para o tratamento da toxicidade induzida pelo álcool.
No trato digestivo superior, 25-68% dos cânceres são atribuídos ao álcool e mais de 80% desses tumores podem ser prevenidos pela abstinência do álcool e fumo 33. Globalmente, a fração atribuível às mortes de câncer devida a bebida alcoólica é informada ser de 3,5% 34. O número de mortes de câncer que se sabe estar relacionada ao consumo de álcool nos EUA poderia ser menor que 6% (como em Utah) ou maior que 25% (como em Porto Rico). Estes números variam de país para país, e na França tem uma freqüência Ed 20% nos homens 18.
Dieta
Em 1981, Doll e Peto 21 estimaram que aproximadamente 30-35% das mortes de câncer nos EUA estão ligadas à dieta (Fig. 4). A dimensão com que a dieta participa nas mortes de câncer varia em grande modo, de acordo com o tipo de câncer 35. Por exemplo, a dieta está ligada às mortes de câncer em muitos dos 70% dos casos de câncer cólon-retal. Como a dieta contribui para o câncer não está totalmente compreendida. Muitos carcinógenos que são ingeridos, como os nitratos, nitrosaminas, pesticidas e dioxinas, provêm dos alimentos, aditivos ou do cozimento.
Mortes de câncer (%) ligadas à dieta relatado por Willett (veja 35).
Consumo intenso de carne vermelha é um fator de risco para muitos cânceres, especialmente àqueles do trato gastrointestinal, mas também do cólon-retal 36–38, próstata 39, bexiga 40, mama 41, gástrico 42, pancreático e oral 43. Embora um estudo de Dosil-Diaz et al., 44 tenha mostrado que o consumo de carne vermelha reduziu o risco de câncer de pulmão, esse consumo geralmente está relacionado a um risco para câncer pela seguinte razão: as aminas heterocíclicas produzidas durante o cozimento da carne são carcinogênicas. Assar carne com carvão e/ou com a cura da fumaça produz componentes carbonados prejudiciais como pirolisatos e aminoácidos, que têm um forte efeito cancerígeno. Por exemplo, o PhIP (2-amino-1-metil-6-fenil-imidazo[4,5-b]piridino) é o mutagênico mais abundante por massa no cozimento do bife e é o responsável por ~20% da mutagenicidade total encontrada em bifes fritos. A ingestão diária de PhIP entre americanos é estimado entre 280-460ng/dia por pessoa 45.
Nitritos e nitratos são usados na carne porque eles ligam a mioglobina, inibindo a produção da exotoxina botulínica; contudo, eles são carcinógenos poderosos 46. Exposição em longo prazo a aditivos alimentares como conservantes nitritos e tinturas a base de azo estão associados à indução da carcinogênese 47. Além disso, o bisfenol das vasilhas plásticas no armazenamento de alimentos pode ser transferido para o alimento e aumentar o risco de câncer de mama 48 e próstata 49. A ingestão de arsênico pode aumentar o risco de câncer de bexiga, rim, fígado e pulmão 50. Os ácidos graxos saturados, gordura saturada, açúcares e farinhas refinadas presentes em muitos alimentos também têm sido associados a vários cânceres. Muitos alimentos carcinógenos demonstraram-se ativar a via inflamatória.
Obesidade
De acordo com um estudo da Sociedade Americana de Câncer 51, a obesidade está associada com um aumento da mortalidade dos cânceres de cólon, mama (em mulheres menopausadas), endométrio, rins (célula renal), esôfago (adenocarcinoma), cárdia gástrico, pâncreas, próstata, vesícula biliar e fígado (Fig. 5). Descobertas deste estudo sugerem que de todas as mortes de câncer nos Estados Unidos, 14% nos homens e 20% nas mulheres são atribuídas ao excesso de peso ou obesidade. Um aumento na modernização e uma dieta e estilo de ocidentalizado são associados com uma elevação da prevalência das pessoas com sobre peso em muitos países desenvolvidos 52.
Vários cânceres que estão ligados à obesidade. Nos EUA o sobre peso e a obesidade pode ser o responsável por 14% de todas as mortes de câncer nos homens e 20% daquelas nas mulheres (veja 51).
Estudos mostraram que o denominador comum entre obesidade e câncer inclui neuroquímicos; hormônios como Fator de Crescimento Semelhante da Insulina 1 (IGF-1), insulina, leptina; esteróides sexuais; adiposidade; resistência à insulina e inflamação 53.
Envolvimento de vias de sinalização como a da IGF/insulina/Akt, a via leptina/JAK/STAT e outras cascatas inflamatórias estão ligadas tanto à obesidade quanto ao câncer 53. Por exemplo, a hiperglicemia, demonstrou-se ativar a NF-κB 54, a qual poderia ligar a obesidade com câncer. Sabe-se também que para ativar o NF-κB são produzidas muitas citoquinas por adipócitos, como a leptina, fator de necrose tumoral (TNF) e interleucina-1 (IL-1) 55. Balanço energético e carcinogênese estão intimamente ligados 53. Porém, se os inibidores destas cascatas de sinalização podem reduzir o risco de câncer relacionado à obesidade continua sem resposta. Por causa do envolvimento de múltiplas vias de sinalização, um agente potencial multisegmentado seria provavelmente necessário para reduzir o risco de câncer relacionado à obesidade.
Agentes Infecciosos
Em todo o mundo, estima-se que 17,8% das neoplasias estão associadas com infecções; esta percentagem varia de menos de 10% em países de renda elevada a 25% nos países africanos 56, 57. Os vírus respondem pela maioria das infecções que causam câncer (Fig. 6). O Papiloma vírus, vírus Epstein Barr, herpes vírus associado ao sarcoma de Kaposi, vírus linfotrópico-T humano 1, HIV, HBV e HCV estão associados com riscos para câncer cervical, ano genital, pele, nasofaringe, linfoma de Burkitt, linfoma de Hodgkin, sarcoma de Kaposi, leucemia de célula T adulta, linfoma de célula B e câncer de fígado.
Vários cânceres estão ligados à infecção. A estimativa total de infecção atribuída ao câncer no ano de 2002 foi de 17,8% de todo o ônus do câncer global. Os agentes infecciosos associados com cada tipo de câncer é mostrado em parênteses. HPV humano (mais ...)
Nos países desenvolvidos do ocidente, o papiloma vírus humano e o HBV são os mais frequentemente encontrados como viroses oncogênicas do DNA. O papiloma vírus humano é diretamente mutagênico por induzir os genes E6 e E7 viral 58, ao passo que o HBV acredita-se ser mutagênico indireto por gerar espécies reativas ao oxigênio através da inflamação crônica 59–61. O vírus linfotrópíco T humano é mutagênico direto, enquanto que o HCV (assim como o HBV) crê-se que produza estresse oxidativo em células infectadas e, assim, atuem de forma indireta por intermédio da inflamação crônica 62, 63.
Contudo, outros microorganismos, inclusive parasitas selecionados como Opisthorchis viverrini ou Schistosoma haematobium e bactérias como o Helicobacter pylori, também podem estar envolvidos, agindo como co-fatores e /ou carcinógenos 64.
Os mecanismos pelos quais os agentes infecciosos promovem o câncer estão se tornando cada vez mais evidentes. Inflamação relacionada à infecção é o principal fator de risco para câncer, e quase todas as viroses ligadas ao câncer mostraram-se ativar o marcador inflamatório NF-κB 65. Semelhantemente, componentes do Helicobacter pylori ativou o NF-κB 66. Portanto, agentes que possam bloquear a inflamação crônica deveriam ser efetivos em tratar estas condições.
Poluição Ambiental
A poluição ambiental tem sido ligada a vários cânceres (Fig. 7). Isto inclui poluição atmosférica externa por partículas de carbono associadas com hidrocarbonetos policíclicos aromáticos (PAHs); poluição atmosférica interna pela fumaça do cigarro, formaldeído e componentes orgânicos voláteis como benzeno 1,3-butadieno (que podem afetar particularmente as crianças); poluição de alimentos através de aditivos e por contaminantes carcinogênicos como nitrato, pesticidas, dioxinas e outros organoclorinas; metais carcinogênicos e metalóides; remédio de farmácia e cosméticos 64.
Vários cânceres estão ligados a carcinógenos ambientais. Os carcinógenos ligados a cada câncer é mostrado no quadro ao lado (veja 64).
Inúmeros poluentes atmosféricos externos como o PAHs aumentam o risco de câncer, especialmente o de pulmão. Os PAHs podem se aderir a finas partículas de carbono da atmosfera e depois penetrar em nosso organismo, principalmente, através da respiração. Exposição prolongada ao PAHs presente nas cidades poluídas foi encontrado em mortes de câncer de pulmão. Ao lado do PAHs e outras finas partículas de carbono, mais um poluente ambiental, o óxido nítrico, sabe-se que aumenta o risco de câncer de pulmão nas populações de não fumantes na Europa. Outros estudos mostram que o óxido nítrico pode induzir ao câncer de pulmão e promover metástases. O risco elevado de leucemia em crianças associado com exposição à fumaça do escapamento de veículos motorizados, como compostos orgânicos voláteis e pesticidas aumentam o risco de leucemia infantil, e crianças tanto quanto os adultos expostos aos pesticidas têm um risco aumentado de tumores do cérebro, tumor de Wilms, sarcoma de Ewing e tumor de células germinativas. Intra-útero a exposição ambiental a poluentes orgânicos se relaciona com o aumento do risco para câncer de testículo. Além disso, o dioxano, um poluente ambiental de incineradores, sabe-se que eleva o risco de sarcoma e linfoma. A exposição prolongada a bebidas cloradas foi associada ao risco aumentado de câncer. Nitratos, em água potável, podem transformar os componentes mutagênicos N-nitrosos, os quais elevam o risco de linfoma, leucemia, cólon-retal e de bexiga 64.
Radiação
Mais de 10% do total de todos os casos de câncer podem ser induzidos pela radiação 64, tanto a ionizante quanto a não ionizante, tipicamente de substância radioativa e ultravioleta (UV), campos eletromagnéticos pulsantes. A indução de câncer pela radiação inclui alguns tipos de leucemia, linfoma, câncer da tireóide, câncer de pele, sarcomas, carcinomas de pulmão e mama. Um dos melhores exemplos de risco elevado de câncer após a exposição à radiação é o aumento da incidência de neoplasias observadas na Suécia depois da exposição radioativa no vazamento da fábrica energia nuclear em Chernobyl. Rádon ou radônio deteriora os produtos em casa e/ou locais de trabalho (como minas) são as fontes mais comuns de exposição à radiação ionizante. A presença de núcleo radioativo de radônio, rádio e urânio sabe-se que aumenta o risco de câncer gástrico em ratos. Outra fonte de exposição à radiação é o Raio-X usado em ambiente hospitalar para diagnóstico ou para fins terapêuticos. Na realidade, o risco de câncer de mama por Raio-x é mais alto entre as moças expostas a radiografia de tórax na puberdade, época de intenso desenvolvimento da mama. Outros fatores associados com cânceres induzidos pela radiação em humanos são a idade do paciente e estado fisiológico, interações sinérgicas entre radiação e carcinógenos, e a suscetibilidade genética diante da radiação. A radiação não ionizante deriva principalmente da luz solar inclusive os raios UV, os quais são carcinogênicos para os seres humanos. Exposição à radiação UV é o principal risco para vários tipos de câncer de pele inclusive o carcinoma baso-celular, carcinoma de células escamosas e melanoma. Junto com a exposição ao UV solar, expor-se em câmaras de bronzeamento artificial com finalidade cosmética pode estar relacionado ao aumento da incidência de melanoma. A deterioração da camada de ozônio na estratosfera pode ampliar a intensidade da dose de UVB e UVC, os quais podem intensificar o aumento da incidência de câncer de pele.
Campos eletromagnéticos de baixa freqüência podem causar lesão clastogênica do DNA. As fontes dos campos eletromagnéticos estão nas linhas de transmissão de alta voltagem, transformadores, trens elétricos e mais comumente, todos os tipos de equipamentos elétricos. Um risco elevado de cânceres como a leucemia infantil, tumores cerebrais e câncer de mama foi atribuído à exposição de campo eletromagnético. Por exemplo, crianças que vivem a 200 m das linhas de transmissão têm um risco relativo de leucemia de 69% comparado com aquelas que vivem entre 200 a 600 m destas linhas de transmissão, as quais têm um risco relativo de 23%. Além disso, uma recente meta-análise de todos os dados epidemiológicos disponíveis mostrou que um uso prolongado diário a telefone celular, por 10 anos ou mais, mostrou um padrão consistente de alto risco para tumores cerebrais 64.
PREVENÇÃO DO CÂNCER
O fato de que apenas 5-10% de todos os casos de câncer estão relacionados a defeitos genéticos e os demais, 90-95%, é devido ao ambiente e ao estilo de vida provêem oportunidades importantes para a prevenção do câncer. Pelo fato do cigarro, dieta, infecção, obesidade e outros fatores contribuírem em torno de 30%, 30–35%, 15–20%, 10–20%, e 10–15%, respectivamente, para a incidência de todas as mortes de câncer nos EUA, evidencia que podemos preveni-lo. Quase 90% dos pacientes diagnosticados com câncer de pulmão são fumantes; e a fumaça do cigarro combinado com a ingestão de álcool pode, de forma sinérgica, contribuir para a tumorogênese. Semelhantemente, os cigarros sem fumaça são responsáveis por 400.000 casos (4% do total) de câncer oral no mundo. Portanto, evitar produtos com tabaco e minimizar o consumo de álcool teria um efeito importante sobre a incidência de câncer.
Infecções por várias bactérias e vírus (Fig. 6) é outra causa muito proeminente de vários cânceres. Vacina para câncer cervical e HCC deveria ajudar a prevenir alguns destes, além de um ambiente limpo e modificação de hábitos do estilo de vida seria mais útil na prevenção de câncer causado por infecção. O primeiro agente quimiopreventivo aprovado pelo FDA foi o Tamoxifeno, pois reduzia o risco de câncer de mama. Este agente se descobriu reduzir a incidência de câncer de mama em 50% das mulheres com alto risco. Com o tamoxifeno, há um risco elevado de efeitos colaterais como câncer uterino, trombose, distúrbios oculares, hipercalcemia e derrame (http://www.fda.gov/cder/foi/appletter/1998/17970s40.pdf). Recentemente foi mostrado que uma droga para osteoporose, raloxifeno, é tão efetivo quanto o tamoxifeno na prevenção positiva no receptor de estrogênio, o câncer de mama invasivo, mas tem menor efeito colateral que o tamoxifeno. Embora ele seja melhor que o tamoxifeno com relação aos efeitos colaterais ele pode causar trombose e derrame. Outro efeito colateral potente do raloxifeno inclui fogachos, cãibras das pernas, edema de membros inferiores e pés, sintomas semelhantes a gripe, dor articular e sudorese (http://www.fda.gov/bbs/topics/NEWS/2007/NEW01698.html).
O segundo agente quimiopreventivo que chegou à clínica foi a finasterida, para câncer de próstata, que se descobriu reduzir a incidência em 25% em homens com alto risco. Os efeitos colaterais reconhecidos deste agente incluem disfunção erétil, diminuição do desejo sexual, impotência e ginecomastia (http://www.cancer.org/docroot/cri/content/cri_2_4_2x_can_prostate_cancer_be_prevented_36.asp). Celecoxibe, um inibidor da COX-2 é outro agente aprovado para prevenção da polipose familiar adenomatosa (PAF). Contudo, o benefício do celecoxibe é a custa de seus graves danos cardiovasculares (http://www.fda.gov/cder/drug/infopage/cox2/NSAIDdecisionMemo.pdf). Os graves efeitos colaterais das drogas quimiopreventivas, aprovados pelo FDA, é um tema de particular interesse quando se considera sua administração prolongada à saúde das pessoas que podem ou não desenvolver câncer. Isto indica claramente a necessidade de agentes, que sejam seguros e eficientes na prevenção de câncer. A dieta oriunda de produtos naturais seriam candidatos em potencial para este propósito.
Dieta, obesidade e síndrome metabólica estão intimamente ligados a vários cânceres e podem estar relacionados com mais de 30-35% das mortes de câncer, indicando que uma fração razoável dessas mortes poderiam ser prevenidas pela mudança da dieta. Pesquisas abarcantes revelaram que uma dieta constituída por frutas, vegetais, ervas e grãos têm potencial para prevenir câncer (Fig. 8). As substâncias específicas nestes alimentos dietéticos são responsáveis na prevenção do câncer e os mecanismos pelos quais eles realizam isto também foram extensivamente examinados. Vários fitoquímicos foram identificados nas frutas, vegetais, temperos e grãos que exibem potencial quimiopreventivo (Fig. 9). Numerosos estudos têm mostrado que uma dieta adequada pode ajudar a proteger contra o câncer 46, 67–69. Abaixo há uma descrição de agentes alimentares adequados e fitoquímicos derivados da dieta para determinar seu papel na prevenção do câncer.
Frutas, vegetais, temperos, condimentos e cereais com potencial para prevenir câncer. As frutas incluídas são: 1 maçã, 2 damasco, 3 banana, 4 amora silvestre 5 cereja, 6 frutas cítricas, 7 sobremesa de tâmara, 8 durian, 9 uvas, 10 goiaba, 11 framboesa indiana, 12 manga, 13 (mais ...)
Fitoquímicos derivados de frutas, vegetais, temperos, condimentos e cereais com potencial para prevenir câncer. 1 diosgenina, 2 glicerizina, 3 ácido glicerritínico, 4 18-β-ácido glicerritínico, 5 oleandro, 6 ácido oleanólico, 7 ácido betulínico, (mais ...)
Frutas e vegetais
O papel protetor de frutas e vegetais contra cânceres que ocorrem em vários sítios anatômicos é agora bem apoiado 46,69. Em 1996, Wattenberg 70 propôs, pela primeira vez, que o consumo regular de certos constituintes em frutas e vegetais pode fornecer proteção para o câncer. Doll e Peto 21 mostraram que de 75-80% dos casos de câncer diagnosticados nos EUA em 1981, poderiam ter sido evitados pela mudança no estilo de vida. De acordo com estimativa de 1997, aproximadamente 30-40% dos casos de câncer mundial são evitáveis por mudanças dietéticas exequíveis (http://www.dietandcancerreportorg/?p=ER). Muitos estudos relacionam o câncer com os efeitos quimiopreventivos dos compostos ativos derivados das frutas e vegetais
Mais de 25.000 diferentes fitoquímicos foram identificados possuindo potencial contra vários cânceres. Estes fitoquímicos têm vantagens porque eles são seguros e normalmente atingem múltiplas vias sinalizadoras de células 71. Os principais componentes identificados das frutas e vegetais incluem os carotenóides, vitaminas, resveratrol, quercetina, silimarina, sulforane e indol-3-carbinol.
Carotenóides
Vários carotenóides naturais presentes nas frutas e vegetais foram descritos possuírem atividade anti-inflamatória e anti-carcinogênica. O licopeno é um dos principais carotenóides na dieta regional do Mediterrâneo além de contar com 50% dos carotenóides do soro humano. O licopeno está presente nas frutas, incluindo melancia, damasco, goiaba rosa, toronja, rosa mosqueta e tomates. Uma grande variedade de produtos baseados em tomates processados possui mais de 85% do licopeno da dieta. A atividade anti-câncer do licopeno foi demonstrado em modelos de tumores tanto in vivo quanto in vitro, assim como em humanos. Os mecanismos propostos para os efeitos anti-câncer do licopeno envolvem moléculas degradadoras de ROS (espécies reativas ao oxigênio), regulação positiva dos sistemas de desintoxicação, interferência com proliferação celular, indução da comunicação das junções tipo gap, inibição da progressão do ciclo celular e modulação da via de transdução de sinal. Outros carotenóides relacionados à atividade anti-câncer incluem: beta-carotenóide, alfa-caroteno, luteína, zeaxantina, beta-criptoxantina, fucoxantina, astaxantina, capsantina, crocetina e o fitoeno72.
Resveratrol
O estilbeno resveratrol foi encontrado em frutas como uva, amendoins e bagas. O resveratrol exibe propriedades anti-câncer contra uma grande variedade de tumores, incluindo o câncer linfóide e mielóide, múltiplos mielomas e cânceres de mama, próstata, estômago, cólon e pâncreas. Os efeitos inibidores de crescimento do resveratrol são mediados pelo controle do ciclo celular; indução de apoptose via Fas/CD95, p53, ativação de ceramida, polimerização da tubulina, via adenil-ciclase e mitocondrial; regulação positiva do p21 p53 e Bax; infra-regulação da survivina, ciclina D1, ciclina E, Bcl-2, Bcl-xL, e inibidor celular da apoptose de proteínas; ativação das caspases; supressão da síntese óxido nítrico; supressão da transcrição de fatores tais como NF-κB, AP-1, e precocemente à resposta-1 de crescimento; inibição da ciclo-oxigenase-2 (COX-2) e lipoxigenase; supressão da adesão de moléculas e inibição da angiogênese, invasão e metástase. Dados restritos a humanos revelam que o resveratrol é farmacologicamente seguro. Sendo um nutriente celular, o resveratrol está disponível comercialmente nos EUA e Europa na dosagem de 50 µg a 60 mg. Atualmente, análogos estruturais do resveratrol com melhora da biodisponibilidade são procurados como potenciais agentes quimopreventivos e terapêuticos para o câncer 73.
Quercetina
A quercetina flavona (3,3′,4′,5,7-penta-hidróxi-flavona) um dos principais flavonóides da dieta, é encontrado numa grande variedade de frutas, vegetais e bebidas como o chá e o vinho. Sua ingestão diária nos países ocidentais é de 25-30 mg. Os efeitos anti-oxidantes, anti-inflamatórios, anti-proliferativos e apoptóticos da molécula têm sido amplamente analisado em modelos de cultura de células; ele é reconhecido por bloquear a ativação do NF-κB. Em modelos animais, a quercetina demonstrou-se inibir a inflamação e prevenir o câncer de cólon e pulmão. Uma primeira fase clínica de testes indicou que a molécula pode ser administrada com segurança e de que os níveis plasmáticos são suficientes para inibir a atividade linfocítica da tirosina quinase. O consumo de quercetina em cebolas e maçãs sabe-se que é inversamente proporcional ao risco de câncer de pulmão no Havaí. O efeito das cebolas foi particularmente forte contra o carcinoma de células escamosas. Outro estudo acompanhou uma elevação do nível plasmático de quercetina após uma refeição de cebolas por aumento da resistência à quebra na cadeia no DNA linfocítico e pela diminuição dos níveis de alguns metabólitos oxidativos na urina 74.
Silimarina
O flavonóide silimarina (silibina, isosilibina, silicristina, silidianina e taxifolina) é normalmente encontrado na fruta seca da planta milk thistle Silybum marianum. Embora o papel da silimarina como agente anti-oxidante e hepato protetor sejam bem conhecidos sua ação como agente anti cancerígeno está emergindo. Os efeitos anti-inflamatórios da silimarina são mediados através da supressão dos produtos dos genes regulado pelo NF-κB, inclusive o COX-2, lipoxigenase (LOX), indutor da síntese do NO, TNF e IL-1. Vários estudos têm indicado que a silimarina é um agente quimiopreventivo in vivo contra vários promotores tumor/carcinógeno, incluindo a luz UV, 7,12 dimetilbenzeno(a)antraceno (DMBA), forbol 12- myristate 13-acetato e outros. A silimarina também se mostrou sensível à baixa regulação da proteína MDR (drogas multi resistentes) e outros mecanismos. Ela se liga tanto aos receptores de estrogênio quanto de androgênio e a baixa regulação do antígeno prostático específico. Em acréscimo aos seus efeitos quimopreventivos, a silimarina apresenta atividade contra tumores (ex. próstata e ovários) em camundongos. Vários ensaios clínicos indicaram que a silimarina é biodisponível e farmacologicamente segura. Estudos estão agora em progresso para demonstrar a eficácia clínica da silimarina contra vários cânceres 75.
Indol-3-carbinol
O flavonóide indol-3-carbinol (I3C) está presente em vegetais como repolho, brócoli, couve-de-bruxelas, ouve-flor, e alcachofra rábano. O produto da hidrólise do I3C metaboliza uma variedade de produtos, inclusive o polímero 3,3′-diindolmetano. Tanto o I3C quanto o 3,3′-diindolmetano exercem uma gama de efeitos biológico e bioquímico, muitos dos quais parecem ocorrer porque o I3C modula muito os fatores de transcrição nuclear. A fase 1 do I3C induz as enzimas da fase 2 que metabolizam carcinógenos, inclusive estrógenos. O I3C também parece ser efetivo no tratamento de alguns casos de papilomatose respiratória recorrente e pode ter outros usos clínicos 76.
Sulforane
O sulforane (SFN) é um isotiocianato encontrado em vegetais crucíferos como o brócolis. Seus efeitos quimopreventivos foram estabelecidos em estudos in vitro e in vivo. O mecanismo de ação do SFN inclui a inibição da fase de enzimas, indução da fase 2 e desintoxicação carcinogênica, controle do ciclo celular, indução da apoptose, inibição de histona deacetilase, modulação da via do (MAPK= Proteína Cinase Ativada por Mitógeno), inibição do NF-κB e produção de ROS. Estudos pré-clínicos e clínicos deste composto sugerem seus efeitos quimopreventivos em muitos estágios da carcinogênese. Em um teste clínico, o SFN foi dado a oito mulheres saudáveis uma hora antes delas se submeterem a uma redução cirúrgica da mama. Indução em NAD(P)H/quinona oxidoredutase e heme oxigenase-1 foi observada no tecido mamário de todas as pacientes, indicando o efeito anti-câncer da SFN 77.
Chás e Ervas
Ervas são usadas em todo o mundo para acrescentar sabor, gosto e valor nutricional aos alimentos. Um grupo cada vez maior de pesquisadores tem demonstrado que fitoquímicos como as catequinas (chá verde), curcumina (turmeric), dialil-dissulfide (alho), timoquinona (cominho preto), capsaicina (pimenta vermelha), gingerol (gengibre), anatol (alcaçuz), diosgenin (feno grego) e eugenol (cravo-da-índia, canela) possuem potenciais terapêuticos e preventivos contra cânceres de várias origens anatômicas. Outros fitoquímicos com este potencial incluem o ácido elágico (cravo-da-índia), ácido fenólico (erva-doce, mostarda, gergelim), apigenina (coentro, salsinha), ácido betulínico (alecrim), quempferol (cravo-da-índia, feno grego), sesamin (gergelim) piperina (pimenta preta), limoneno (alecrim) e o ácido gambógico (brindoeiro). Abaixo está uma descrição de alguns fitoquímicos importantes associados ao câncer.
Catequinas
Mais de 3000 estudos têm mostrado que as catequinas derivadas dos chás verdes e pretos têm potencial contra vários tipos de cânceres. Uma quantidade limitada de dados também estão disponíveis em testes para a quimioprevenção do polifenol do chá verde. Testes na fase 1 em voluntários saudáveis definiram os padrões de biodistribuição básicos, parâmetros farmacocinéticos e perfis de segurança preliminares para a administração oral a curto prazo de preparações de vários chá verdes. O consumo de chá verde parece ser relativamente seguro. Entre os pacientes com condições pré-malignas estabelecidas, derivados do chá verde demonstraram potencial eficácia contra neoplasias cervical, próstata e hepática sem produzir importantes efeitos tóxicos. Um estudo recente determinou que até pessoas com tumores sólidos poderia consumir, com segurança, 1g de chá verde sólido, o que equivale a aproximadamente 900 ml de chá, três vezes ao dia. Esta observação apóia o uso de chá verde tanto para a prevenção quanto para o tratamento de câncer 78.
Curcumina
A curcumina é um dos componentes isolados mais exaustivamente estudados das fontes dietéticas na inibição da inflamação e quimioprevenção de câncer, como indicado por quase 3000 estudos publicados. Estudos em nosso laboratório mostraram que a curcumina inibiu o fator NF-κB e a expressão do gene regulador da NF-κB em várias linhas celulares de câncer. Estudos in vitro e in vivo mostrou que este fitoquímico inibiu a inflamação e carcinogênese em modelos animais, incluindo modelos de câncer de mama, esôfago, estômago e cólon. Outros estudos mostraram que a curcumina inibe proctite ulcerativa e a doença de Crohn; e um deles demonstrou que a curcumina inibiu a colite ulcerativa em humanos. Outro estudo avaliou o efeito de uma combinação de curcumina e piperina em pacientes com pancreatite tropical. Um estudo conduzido em pacientes com polipose adenomatosa familiar mostrou que a curcumina tem um papel potencial na inibição desta condição. Nesse estudo, todos os cinco pacientes foram tratados com curcumina e quercetina por um tempo mínimo de seis meses apresentando uma diminuição do número (60,4%) e do tamanho (50,9%) de pólipos com um patamar de efeitos adversos mínimos e nenhuma anormalidade determinada em laboratório.
O efeito farmacodinâmico e farmacocinético do extrato oral de Curcuma em pacientes com câncer cólon retal também foi estudado. Num estudo de pacientes com avançado câncer cólon retal refratário a quimioterapia padrão, 15 pacientes receberam extrato de Curcuma diariamente por mais de 4 meses. Os resultados mostraram que o extrato oral de Curcuma foi bem tolerado e não foram observados efeitos tóxicos limitados a dose. Outro estudo demonstrou que em pacientes com avançado estado de câncer cólon retal, uma dose diária de 3,6 g de curcumina proporcionou uma diminuição de 62% na indução de produção da prostaglandina E2 no primeiro dia e uma diminuição de 57% no 29º dia em amostras de sangue colhidas 1 hora após a administração da dose.
Num teste clínico recente com 62 pacientes apresentando lesões cancerosas externas em vários locais (mama, 37; vulva, 4; boca, 7; pele 7 e outros, 11), descreveu-se uma redução no odor (90% dos pacientes), prurido (quase todos), tamanho da lesão e dor (10% dos pacientes) e exsudatos (79% dos pacientes) após aplicação tópica de um ungüento contendo curcumina. Na primeira fase do teste, uma dose diária de 8000 mg de curcumina ingerido por 3 meses resultou em melhora das lesões histológicas pré-malignas em pacientes com neoplasia cervical intra-epitelial uterina (um de quatro dos pacientes), metaplasia intestinal (um de seis pacientes), câncer de bexiga (um de dois pacientes) e leucoplasia oral (dois de sete pacientes).
Resultados de outro estudo conduzido por nosso grupo mostrou que a curcumina inibiu a ativação constitutiva do NF-κB, COX-2 e STAT3 em células mononucleares do sangue periférico de 29 pacientes com mieloma múltiplo envolvidos nesse estudo. A curcumina foi dada em doses de 2, 4, 8 ou 12 g/dia via oral. O tratamento com curcumina foi bem tolerado sem nenhum efeito adverso. Dos 29 pacientes, 12 receberam tratamento por 12 semanas e 5 completaram 1 ano de tratamento com a doença estável. Outros estudos de nosso grupo mostraram que a curcumina inibiu o câncer pancreático. A curcumina diminui a resposta da expressão do NF-κB, COX-2, e STAT3 fosforilado em células moleculares do sangue periférico (muitos dos quais têm níveis basais consideravelmente elevados mais do que os encontrados em voluntários saudáveis). Estes estudos demonstraram que a curcumina é um potente agente antiinflamatório e quimiopreventivo. Uma descrição detalhada da curcumina e de suas propriedades anti-câncer podem ser encontradas em uma de nossas revisões recentes 79.
Dialil sulfito
O dialil sulfito, isolado do alho, inibe o crescimento e a proliferação de uma série de células cancerosas incluindo a linhagem celular do cólon, mama, glioblastoma, melanoma e neuroblastoma. Estudos recentes mostraram que este composto induz a apoptose em células de câncer de cólon (Colo 320 DM) humana pela inibição da COX-2, NF-κB e ERK-2. Foi demonstrado inibir vários cânceres inclusive o de cólon induzido pela dimetil hidrazina, neoplasia induzida pelo benzopireno e glutatione S-transferase atividade em roedores; benzopireno indutor de câncer de pele em ratos; N-nitro metilbenzamida, induz ao câncer de esôfago em ratos; N-nitrosodietilamina – induz à neoplasia no pré-estômago em fêmeas de roedores; ácido aristolóquio – induz a carcinogênese em ratos; dietil nitrosamina – induzido pela glutatione S-transferase foco positivo em fígado de rato; 2-amino-3-metil-imidazol[4,5-f]quinoline – induziu a hepato carcinogênese em ratos e dietilnitrosamina – induziu a adenomas em foco hepático e hepatocelular em roedores C3H. O dialil sulfito também mostrou que inibe a mutagênese ou tumorogênese induzido pelo vinil carbamato e N-nitrosodimetilamina; aflatoxina B1-induzirda e a N-nitrosodietilamina-induzida em focos paraneolplásicos em fígado deratos; a atividade da arilamina N-acetiltransferase e da 2-aminofluorene no DNA de células humanas adultas na leucemia promielocítica; tumores de pele em ratos DMBA-induzida; mutação N-nitrosometilbenzilamina-induzida em esôfago de ratos; e tumores de mamas em DNA de ratas adultas innduzido pelo dietiletilbestrol.
Dialisulfito crê-se que traz acredita-se que provoca um efeito anticarcinogênico por vários mecanismos, como a remoção de radicais; elevando os níveis da gluationa; aumentando as atividades de enzimas como glutationa S-transferase e catalase; inibindo o citocromo p4502E1 e reparando mecanismos do DNA; e prevenindo a lesão do cromossomo (80).
Timoquinona
Os agentes quimioterápicos e quimioprotetores do cominho preto incluem a timoquinona (TQ), ditimoquinona (DTQ) e timohidroquinona presentes no óleo destas sementes. A TQ tem atividade anti-neoplásica contra várias células tumorais. A DTQ também contribui para os efeitos quimioterápicos da Nigella sativa. Resultados de estudos in vitro indicaram que a DTQ e a TQ são igualmente citotóxicas para várias linhagens de células parentais e de tumores de linhagem de células humanas e ao seu correspondente às drogas multi resistentes. TQ induz a apoptose através das vias p53 dependentes e independentes em linhagens de células cancerosas. Também induz o controle do ciclo celular e modula os níveis de mediadores inflamatórios. Para datar, não foi testado o potencial quimioterápico da TQ, mas numerosos estudos mostraram seus efeitos anticâncer promissores em modelos animais. A TQ suprime a indução carcinogênica e a formação de tumor de pele em ratos e atua como um agente quimiopreventivo na fase precoce da tumorogênese de pele. Além disso, a combinação de TQ, usado clinicamente como droga anticâncer mostrou que melhora o índice terapêutico da droga, protegendo tecidos não tumorais de sustentar lesão induzida pela quimioterapia, aumentando a atividade antitumoral de drogas como a cisplatina e ifosfamide. Um relatório muito recente, de nosso próprio grupo, estabeleceu que a TQ afeta a via de sinalização do NF-κB por suprimir o NF -κB e os produtos de genes regulados pelo NF-κB (81).
Capsaicina
O composto fenólico capsaicina (8-metil-N-vanila-6-nonenamida), um componente da pimenta malagueta, foi estudada exaustivamente. Embora a capsaicina tenha levantado a suspeita de ser carcinogênica, muitas evidências consideráveis sugerem que ela possua efeitos quimiopreventivos. Aas propriedades antioxidantes, antiinflamatórias e antitumorais da capsaicina foram estabelecidas tanto nos sistemas in vitro quanto in vivo. Por exemplo, mostrou-se que a Capsaicina pode suprimir a ativação estimulada do ATP na NF-κB e AP-1 em cultura de células HL-60 Além disso, a capsaicina inibiu a ativação constitutiva do NF-κB em células de melanoma. Além disso, ela suprimiu fortemente a ativação estimulada do ATP do NF-κB e a ativação epidérmica de AP-1 em camundongos. Outro mecanismo proposto é a ação da capsaicina e sua interação com enzimas xenobióticas e metaboliza, envolvidas na ativação e desintoxicação de vários carcinógenos químicos e mutagenes. O metabolismo da Capsaicina através das enzimas hepáticas produz radicais fenóxi reativos intermediários capazes de se ligarem aos locais ativos das enzimas e macromoléculas de tecido.
A Capsaicina pode inibir a agregação de plaquetas e suprimir respostas de pró-inflamatórias do cálcio-ionóforo-estimulada, como a geração de ânion de superóxido, atividade da fosfolipase A2 e peroxidação dos lipídios de membrana em macrófagos. Ela age como um antioxidante em vários órgãos de animais de laboratório. Também foram relatadas propriedades antiinflamatórias da Capsaicina contra inflamação carcinógeno-induzida em ratos e camundongos. A Capsaicina apresentou efeitos protetores contra lesão da mucosa gcástrica induzida pelo etanol, erosão hemorrágica, peroxidação lipídica e atividade da mieloperoxidase em ratos que estiveram associados com a supressão da COX-2. Enquanto falha na atividade intrínseca na promoção do tumor, a Capsaicina inibiu a papillomagênese promovida pelo ATP do câncer de pele em rato (82).
Gingerol
Gingerol, uma substância fenólica presente no gengibre (Zingiber officinale Roscoe), tem diversos efeitos farmacológicos que incluem antioxidante, antiapoptótico e efeitos antiinflamatórios. O gingerol demonstrou possuir propriedades anticâncer e quimiopreventivo e os mecanismos propostos da ação incluem a inibição da expressão da COX-2 pelo bloqueio da via de sinalização p38 MAPK-NF-B. Um relatório detalhado na habilidade câncer-preventiva do gingerol foi apresentado em uma revisão recente por Shukla e Singh (83).
Anetol
Anetol, o principal composto ativo do alcaçuz, mostrou ter atividade anti-câncer. Em 1995, Al-Harbi et al. 84 estudou a atividade antitumoral do anetol contra o Tumor Ascítico de Erlich (TAE) induzido por tumor em modelo com animais. O estudo revelou que o anetol aumentou o tempo de sobrevida, reduziu o peso, o volume tumoral e o peso corporal dos camundongos em relação aos que tinham TAE. Ele também produziu um efeito citotóxico significativo nas células com TAE nas células na pata, reduzindo os níveis de ácidos nucléicos e MDA e aumentou as concentrações de NP-SH.
As mudanças histopatológicas observadas após o tratamento com anetol foram comparáveis àquelas após o tratamento com a droga citotóxica padrão – ciclofosfamida. A frequência da ocorrência micronucleica e a razão de eritrócitos policromáticos para eritrócitos normocromáticos mostrou que o anetol é mitodepressivo e não clastogênico nas células femorais de camundongos. Em 1996, Sen et al., 85 estudou a atividade inibitória da NF-κB de um derivado do anetol e da anetolditioltione. O resultado de seu estudo mostrou que o anetol inibiu a H2O2, PMA ou TNF alfa induzindo a ativação do NF-κB em células jukart humanas (86) estudou a atividade anticarcinogênica do anetol tritione contra DMBA induzido em um modelo de câncer de mama em rato. Os resultados dos estudos mostraram que este fitoquímico inibiu o crescimento do tumor mamário em uma maneira dose-dependente. Nakagawa e Suzuki (87) estudaram o metabolism e mecanismo de ação do trans-anetol (anetol) e atividade semelhante ao estrogênio de componentes e seus metabólitos recentemente isolados de hepatócitos de ratos e cultura de células de câncer de mama MCF-7. Os resultados sugerem que a biotransformação do anetol induz um efeito citotóxico em altas concentrações nos hepatócitos de ratos e um efeito estrogênico em baixas concentrações em culturas de células MCF-7 na base de concentrações de hidroxilados intermediários, 4OHPB. Resultados de estudos pré-clínicos sugerem que o composto organosulfurado anetol ditioletione pode ser um efetivo agente quimiopreventivo contra o câncer de pulmão. Lam et al, (88) conduziu um teste em fase 2b do anetol ditioletione é um agente quimiopreventivo potencialmente eficaz contra câncer de pulmão
Diosgenina
Diosgenina uma saponina esteroidal presente no feno-grego, demonstrou suprimir a inflamação, inibir a proliferação e induzir a apoptose em várias células tumorais. Pesquisas durante a última década mostraram que a diosgenina suprime a proliferação e induz a apoptose em uma grande variedade de linhagens de células cancerosas. Os efeitos anti-proliferativos da diosgenina são mediados pelo controle do ciclo celular, deleção da Ca2+ da homeostase, ativação do p53, liberação do fator indutor da apoptose e modulação da atividade da caspase-3. A diosgenina também inibe focos aberrantes nas criptas do cólon induzido pelo azoximetano. Demonstrou-se que inibe a inflamação intestinal e modula a atividade do LOX e COX-2. A diosgenina também se liga ao receptor da chemokine CXCR3 a qual media respostas inflamatórias. Resultados de nosso próprio laboratório mostraram que a diosgenina inibe a osteoclastogênese, invasão celular e proliferação de células através do down-regulation do Akt, ativação da IκB quinase e pela expressão do gene regulador da NF-κB 89.
Eugenol
O eugenol é um dos componentes ativos do alho. Estudos conduzidos por Ghosh et al. 90 mostrou que ele suprime a proliferação de células do melanoma. Em um estudo, o tratamento do eugenol produziu uma diminuição significativa no crescimento tumoral, uma redução de quase 40% no tamanho do tumor e um aumento de 19% no tempo médio ao ponto final. De maior importância, 50% dos animais no grupo controle morreram de crescimento metastático, considerando que nenhum no grupo de tratamento com eugenol mostrou qualquer sinal de invasão celular ou metástase. Em 1994, Sukumaran et al. 91 mostrou que o eugenol DMBA induziu tumores de pele em camundongos. O mesmo estudo demonstrou que o eugenol inibiu a formação de superóxido, a peroxidação lipídica e a atividade de remoção de radical que pode ser responsável por sua ação quimiopreventiva. Estudos conduzidos por Imaida et al. 92 mostrou que o eugenol acentuou o desenvolvimento do 1,2-dimetilhidrazina induzindo a hiperplasia e papilomas no pré-estômago, mas diminuiu a incidência do 1-metil-1-nitrosuréia induzindo a nefroblastomas renais em fêmeas de camundongos F344.
Outro estudo conduzido por Pisano et al. 93 demonstrou que o dibromo-dehidrodieugenol suscita atividade anti-proliferativa específica sobre as células tumorais ectodérmicas. Em 2003, Kim et al. 94 mostrou que o eugenol suprimi a expressão do RNAm da COX2 (um dos principais genes implicados no processo de inflamação e na carcinogênese) nas células HT-29 e nas células macrófagas RAW264.7 de camundongos estimuladas por lipossacarídeos. Outro estudo de Deigner et al. 95 mostrou que 1-hidróxieugenol é um bom inibidor da 5-lipoxigenase e Cu2+ mediou a oxidação do LDL. Os estudos de Rompelberg et al. 96 mostrou que in vivo o tratamento de camundongos com eugenol reduziu a mutagenicidade do benzopireno. Na Salmonella typhimurium ensaios de mutagenicidade, considerando-se in vitro, o tratamento de cultura de células com eugenol aumentou a genotoxicidade do benzopireno.
Alimentos Integrais
Os principais alimentos integrais são trigo, arroz e milho; os de segunda linha são cevada, sorgo, painço, centeio e aveia. Grãos formam a parte mais importante da dieta de muitas culturas, mas a maioria dos alimentos, em países ocidentalizados, é produto refinado 97. Os grãos integrais contêm quimiopreventivos antioxidantes como vitamina E, tocotrienóis, ácido fenólico e lignanas e o ácido fítico. O conteúdo antioxidante dos grãos integrais é menor que de algumas bagas, mas é maior do que frutas comuns ou vegetais 98. O processo de refino concentra carboidratos e reduz a quantidade de outros macro nutrientes, vitaminas e minerais porque as camadas externas são removidas. Na realidade, todos os nutrientes com ações preventivas potenciais contra o câncer são reduzidos. Por exemplo, a vitamina E está reduzida em mais de 92% 99.
A ingestão de grão integral sabe-se que reduz o risco de muitos cânceres inclusive os da cavidade oral, faringe, esôfago, vesícula biliar, laringe, intestino, colo retal, trato digestivo superior, mamas, fígado, endométrio, ovários, glândula prostática, bexiga, rins e glândula tireóide, assim como linfomas, leucemias e mieloma 100,101.
A ingestão de alimentos integrais nestes estudos reduziu o risco de cânceres em 30-70% 102.
Como os alimentos integrais reduzem o risco de câncer? Muitos mecanismos potenciais foram descritos. Por exemplo, fibras insolúveis, um importante constituinte dos grãos integrais, podem reduzir o risco de câncer de intestino (103). Além disso, as fibras insolúveis sofrem fermentação, assim produzindo ácidos graxos de cadeia curta como o butirato, que é um importante supressor de formação tumoral (104). Os grãos integrais também mediam uma resposta favorável à glicose, a qual é protetora contra cânceres de mama e cólon (105). Também, muitos fitoquímicos dos grãos e pulsos foram relatados terem ação quimiopreventiva contra uma grande variedade de cânceres. Por exemplo, as isoflavonas (inclusive daidzein, genistein, e o equol) são compostos difenólicos encontrados em plantas leguminosas, possuindo atividades antiproliferativas. Descobriu-se que muitos, mas nem todos, os estudos mostraram correlações signnificativas entre uma dieta rica de isoflavona baseada em soja e a redução da incidência de câncer ou mortalidade de câncer em humanos. Nosso laboratório mostrou que os tocotrienóis, mas não os tocoferóis, podem suprimir a ativação do NF-κB induzida por muitos carcinógenos, portanto, levando à supressão de vários genes ligados com a proliferação, sobrevivência, invasão e angiogênese de tumores (106).
Estudos observacionais sugerem que uma dieta rica em soja soflavona (como a dieta típica da Ásia) é um dos fatores de contribuição mais significativos para a baixa observada na incidência e mortalidade de câncer de próstata na Ásia. Na base de resultados sobre dieta e os níveis da excreção urinária associados com daidzein, genistein e equol em temas japoneses comparados com resultados em assuntos americanos ou europeus, os isoflavonóides de soja foram propostos ser os agentes responsáveis para reduzido risco de câncer. Além de seu efeito no câncer de mama, o genistein e as isoflavonas relacionadas também inibem o crescimento da célula ou o desenvolvimento de cânceres quimicamente induzidos no estômago, bexiga, pulmão, próstata e sangue (107).
Vitaminas
Embora controverso, o papel das vitaminas na quimioprevenção do câncer tem sido avaliado crescentemente. Frutas e vegetais são as fontes dietéticas principais de vitaminas com exceção da vitamina D. Vitaminas, especialmente as vitaminas C, D e E, são relatadas possuírem atividade de quimiopreventiva do câncer sem toxicidade aparente.
Resultados de estudos epidemiológicos sugerem que os efeitos anticancerígeno/quimiopreventivo da vitamina C contra vários tipos de cânceres se correlacionam com suas atividades antioxidantes e com a inibição da inflamação na comunicação intercelular junção gap. Resultados de um estudo epidemiológico recente mostraram que uma elevação na concentração de vitamina C no plasma teve uma relação inversa com a mortalidade relacionada ao câncer. Em 1997, comitês de especialistas no Fundo Mundial de Pesquisa do Câncer e do Instituto Americano para Pesquisa de Câncer estimaram que a vitamina C pode reduzir o risco de câncer do estômago, boca, faringe, esôfago, pulmão, pâncreas e cérvice (108).
Os efeitos protetores da vitamina D são o resultado de seu papel como fator de transcrição nuclear que regula o crescimento celular, diferenciação, apoptose e uma gama extensa de mecanismos celulares central para o desenvolvimento de câncer (109).
Atividade Exercício/Físico
Há extensa evidência sugerindo que o exercício físico regular pode reduzir a incidência de vários cânceres. Um estilo de vida sedentário tem sido associado com muitas doenças crônicas. A inatividade física está ligada com risco aumentado de câncer de mama, cólon, próstata, pâncreas e do melanoma (110). O risco elevado de câncer de mama entre mulheres sedentárias que foi demonstrado devido a falta de exercício está associado a uma concentração estradiol mais elevada no soro, menor concentração de globulina ligadora dos hormônios, massa gorda maior e elevação dos níveis de insulina no soro. A inatividade física também pode aumentar o risco de câncer de cólon (provavelmente por causa de um aumento no tempo do trânsito GI, por aumentar assim o tempo de contato com carcinógenos potenciais), elevar os níveis circulantes de insulina (promovendo a proliferação de células do epitélio do cólon), alterar os níveis de prostaglandinas, deprimir a função imune e modificar o metabolismo ácido da bile. Adicionalmente, homens com um baixo nível de atividade física e mulheres com um índice de massa corpórea elevado é mais provável terem uma mutação Ki-ras em seus tumores os quais ocorrem em 30-50% dos cânceres de cólon. Uma redução de quase 50% na incidência de câncer de cólon foi observada entre aqueles com níveis mais elevados de atividade física (111). Semelhantemente, o aumento da testosterona no sangue e dos níveis de IGF-1 em imuno suprimidos devido a falta de exercício pode aumentar a incidência de câncer de próstata. Um estudo indicou que homens sedentários tiveram um aumento de 56% e as mulheres de 72% na incidência de melanoma do que aqueles que se exercitaram de 5 a 7 dias por semana (112).
Restrições calóricas
Jejum é um tipo de restrição calórica (RC) isso é prescrito na maioria das culturas. Talvez um dos primeiros relatórios que a RC pode influenciar na incidência de câncer foi publicada em 1940 sobre a formação de tumores de pele e hepatoma em ratos (113, 114). Desde então, foram publicados vários relatórios sobre este assunto (115, 116). Restrição dietética, especialmente RDC, é um importante modificador na carcinogênese experimental e é conhecida por diminuir significativamente a incidência de neoplasmas. Gross e Dreyfuss relataram que uma restrição de 36% na ingestão calórica diminuiu drasticamente tumores sólidos induzidos à radiação e/ou leucemias (117, 118). Yoshida et al. (119) também mostrou que a RC diminui a incidência de leucemia mielóide induzida por um tratamento único com irradiação de corpo inteiro em ratos.
Como RC reduz a incidência de câncer não é totalmente compreendida. A RC em roedores diminui os níveis de glicose no plasma e da IGF-1 e adia ou atenua câncer e a inflamação sem efeitos adversos irreversíveis (120). Muitos dos estudos feitos sobre o efeito da RC em roedores são a longo prazo; porém, isso não é possível em humanos, que habitualmente praticam a RC transitória. O efeito que a RC transitória tem sobre o câncer em humanos não está claro.
CONCLUSÕES
Na base dos estudos descritos acima, propomos uma hipótese unificando que todos os fatores de estilo de vida que causam câncer (os agentes carcinogênicos) e todos os agentes que previnem câncer (os agentes quimopreventivos) é unida por inflamação crônica (Fig. 10). O fato de que a inflamação crônica está intimamente ligada à via tumorogênica é evidente em numerosas linhas de evidência.
Ativam carcinógenos e os agentes quimopreventivos suprimem a ativação do NF-κB, um importante mediador da inflamação.
Primeiro, marcadores inflamatórios como citoquinas (TNF, IL-1, IL-6, e quimoquinas), enzimas (COX-2, 5-LOX e metaloproteinase-9 [MMP-9]) e moléculas de adesão (molécula de adesão intercellular 1,molécula de adesão leucocítica do endotélio 1 e molécula de adesão de célula vascular 1) estão intimamente ligadas à tumorogênese. Segundo, todos estes produtos de genes inflamatórios foram mostrados ser regulados pelo fator de transcrição nuclear, NF-kB. Terceiro, NF-kB demonstrou-se que controla a expressão de outros produtos dos genes ligados à tumorigênese tais como célula de sobrevivência tumoral ou antiapoptose (Bcl-2, Bcl-xL, IAP-1, IAP-2, XIAP, survivin, cFLIP, e TRAF-1), proliferação (como c-myc e cyclin D1), invasão (MMP-9), e angiogênese (fator de crescimento do endotélio vascular). Quarto, na maioria dos cânceres, a inflamação crônica precede a tumorogênese.
Quinto, a maioria dos carcinógenos e outros fatores de risco para câncer, que incluem a fumaça do cigarro, obesidade, álcool, hiperglicemia, agentes infecciosos, luz solar, estresse, carcinógenos de alimentos e poluente ambientais, mostrou que ativam a NF-kB. Sexto, NF a ativação constitutiva do NF-κB foi encontrada na maioria dos tipos de câncer. Sétimo, a maioria dos agentes quimioterapêutico e radiação gama, usado para o tratamento de câncer, leva a ativação de NF-κB. Oitavo, a ativação do NF-κB é ligado a quimioresistência e radioresistência. Nono, a supressão do NF-κB inibe a proliferação de tumores, leva a apoptose, inibe a invasão e suprime a angiogênese. Décimo, os polimorfismos do TNF, IL-1, IL-6 e os genes ciclina D1, encontrados em vários cânceres, são todos regulados por NF-kB. Também, mutações em genes que codificados por inibidores de NF-kB foram achados em certos cânceres. Décimo primeiro, quase todos os quimiopreventivos descritos acima mostraram suprimir a ativação do NF-kB. Em suma, esta revisão esboça a prevenção do câncer baseado nos principais fatores de risco para câncer. A porcentagem de mortes relacionadas ao câncer atribuível a dieta e tabaco é maior que 60-70% mundial.
Reconhecimento
Esta pesquisa foi apoiada pela Fundação Clayton para Pesquisa (B.B.A.).
Notas de Rodapé
Uma errata a este artigo pode ser encontrada em http://dx.doi.org/10.1007/s11095-008-9690

